Тесты по теме Химические реакции. Часть 4
Предлагаем вашему вниманию тесты по теме Химические реакции с подробными видео-объяснениями (даны сразу после условий задания) и ответами (приведены в конце страницы).
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
1. При разложении хлората калия количеством 3 моль расходуется 250 кДж теплоты. Количество теплоты (кДж), затраченное на разложение технического хлората калия массой 2 кг, содержащего 5% неразлагающихся примесей, равно:
1) 15,51
2) 166,667
3) 1292,5
4) 1900
2. Количество молекул в порции ромбической серы (S8) равно 0,6 моль. В реакции данной порции вещества с избытком алюминия число электронов, переходящих от алюминия к сере, равно:
1) 1,81∙1023
2) 2,89∙1025
3) 3,61∙1024
4) 5,78∙1024
3. Равновесные системы, в которых как повышение температуры, так и понижение давления приводит к смещению равновесия в одной и том же направлении, представлены уравнениями:
а) N2(г) + 3H2 (г) ↔ 2NH3 (г)+ Q;
б) 2SO2 (г) + O2 (г) ↔ 2SO3 (г) + Q;
в) N2 (г) + O2 (г) ↔ 2NO (г) — Q;
г) CO (г) + H2O (г) ↔ CO2 (г) + H2 (г) +Q.
1) а, б
2) б, в
3) б, г
4) в, г
4. Сумма коэффициентов перед веществами молекулярного строения в уравнении реакции, протекающей по схеме PH3 + KMnO4 + HCl → H3PO4 + MnCl2 + KCl + H2O, сотавляет:
1) 7
2) 29
3) 46
4) 70
5. Образование хлороводорода из простых веществ протекает по термохимическому уравнению: H2(г) + Cl2(г) = 2HCl(г) + Q. При разрыве связей в молекулах водорода количеством 1 моль и хлора количеством 1 моль поглощается теплота количеством 436 кДж и 125 кДж соответственно. При образовании связей в молекуле хлороводорода количеством 1 моль выделяется 545 кДж. Рассчитайте общий тепловой эффект реакции в кДж:
1) 16
2) 529
3) 654
4) 1090
6. Коэффициент перед продуктом восстановления в уравнении реакции, протекающей по схеме K2Cr2O7 + NaI + H2SO4 → I2 + Cr2(SO4)3 + Na2SO4 + K2SO4 + H2O, равен:
1) 1
2) 2
3) 3
4) 4
7. В сосуде установилось равновесие H2(г) + Cl2(г) ↔ 2HCl(г) + Q. Укажите верные утверждения:
а) при повышении температуры равновесие смещается в сторону исходных веществ;
б) при понижении давления равновесие смещается в сторону продукта;
в) при понижении температуры скорость прямой реакции уменьшается;
г) скорости прямой и обратной реакции равны в состоянии равновесия.
1) а, в, г
2) а, г
3) в, г
4) б, в
8. Для реакции, схема которой SeO2 (г) + O2 (г) ↔SeO3 (г) + Q, можно утверждать:
а) при охлаждении уменьшается скорость как прямой, так и обратной реакции;
б) при охлаждении скорость прямой реакции увеличивается, а обратной уменьшается;
в) при охлаждении выход продукта уменьшается;
г) повышение давления увеличивает скорость реакции.
1) а, в
2) а, г
3) б, в, г
4) б, в
9. Сумма коэффициентов перед продуктами окисления в схеме MnS +O2 = Mn3O4+ SO2:
1) 3
2) 4
3) 5
4) 12
10. Для осуществления превращений по схеме Fe0 → Fe+3 → Fe0 → Fe+2 укажите ряд, в котором указана последовательность реагентов или условий:
1) Cl2, электролиз расплава, HBr
2) O2, t, KOH
3) Br2, Cu, HNO3 (конц.)
4) H2, O2, H2SO4 (разб.)
11. В равновесной системе 2СО(г) + О2 ↔ 2СО2 + Q повысили температуру и поддерживают её постоянной. Укажите справедливые утверждения для этой системы:
а) количество СО2 увеличивается;
б) количество СО увеличивается;
в) количество О2 уменьшается;
г) общее число молекул увеличивается.
1) а, б
2) а, в
3) б, г
4) в, г
12. Калий растворили в воде, а затем добавили серную кислоту. В ходе описанного эксперимента НЕ протекала реакция:
1) обратимая
2) гомогенная
3) окислительно-восстановительная
4) обмена
13. В разбавленном водном растворе угольная кислота диссоциирует согласно уравнению H2CO3 ↔ H+ + HCO3—. Количество молекул угольной кислоты увеличится при добавлении:
а) гашёной извести;
б) оксида калия;
в) хлороводорода;
г) оксида фосфора (V).
1) в, г
2) б, в
3) а, в, г
4) а, г
14. Сумма коэффициентов перед веществами НЕмолекулярного строения в уравнении реакции, протекающей по схеме Na2S + HNO3 → S + NO + NaNO3 + H2O, равна:
1) 9
2) 12
3) 17
4) 25
15/ В закрытом сосуде протекает гомогенная химическая реакция: А + В = 3С + D. На рисунке изображён график зависимости молярной концентрации (с) вещества D от времени (t)
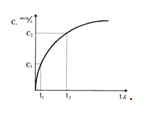 Однозначно можно утвержать, что:
Однозначно можно утвержать, что:
а) до начала реакции молярная концентрация вещества С была равна 0;
б) скорость образования вещества С в 3 раза больше, чем скорость образования вещества D;
в) химическая реакция является экзртермической;
г) скорость расходавания вещества А выше, чем вещества В.
1) а, б
2) а, б, г
3) б
4) в, г
16. В разбавленном водном растворе сернистая кислота существует в виде молекул и ионов — H2SO3 ↔ H+ + HSO3—. Количество молекул сернистой кислоты уменьшится при добавлении:
а) воды;
б) твёрдого гидроксида калия;
в) оксида углерода (IV);
г) концентрированной серной кислоты.
17. Укажите сумму коэффициентов перед веществами молекулярного строения в уравнении реакции, протекающей по схеме: Н2S + КМnО4 + Н2SО4 = S + МnSО4 + К2SО4 + Н2О:
1) 4
2) 5
3) 21
4) 26
18. На рисунке изображены графики зависимости молярных концентраций веществ А и В от времени для гомогенной реакции 4А ↔ Б + 2В, которая протекает в газовой фазе в закрытом сосуде. Укажите выход (%) продукта реакции В:
1) 50
2) 33,3
3) 66,7
4) 85
19. Укажите верные утверждения для реакции, протекающей по схеме СО(г) + Н2(г) ↔ СН3ОН (г) + Q:
а) при нагревании увеличивается скорость обратной реакции и уменьшается выход продукта реакции;
б) повышение давления смещает равновесие в сторону продукта реакции;
в) повысить выход проукта реакции можно путём добавления водорода в равновесную систему;
г) изменение температуры не влияет на скорость реакции.
1) а, г
2) а, в
3) а, б, в
4) б, г
20. Окислительно-восстановительными являются реакции разложения при нагревании:
а) хлората калия;
б) нитрата меди (II);
в) гидросульфита натрия;
г) карбоната кальция.
1) а, б
2) а, в
3) б, г
4) в, г
Ответы:
-
3
-
4
-
1
-
3
-
2
-
1
-
1
-
2
-
2
-
1
-
3
-
1
-
1
-
1
-
3
-
1
-
3
-
3
-
3
-
1
Также предлагаем вам сборку видео-уроков на эту тему:
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
Посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет, а также получить условия всех пробных, тренеровочных и реальных вариантов ЕГЭ, вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»
А также:
- Просмотреть все тесты по органической химии
- Просмотреть все тесты по неорганической химии
- Посмотреть пробные варианты ЦТ вы можете здесь, нажав на эту строку
- Посмотреть пробные и реальные варианты ЕГЭ вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Больше заданий РТ вы можете найти здесь, нажав на эту строку
- Больше заданий ЦТ вы можете найти здесь, нажав на эту строку
- Больше заданий ЕГЭ вы можете найти здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку
