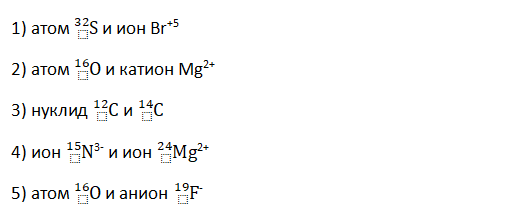Предлагаем вашему вниманию восьмой пробный вариант для подготовки к ЦТ по химии 2020.
Скачать РТ по химии 2019/2020 вариант 8
Вариант 8
Вариант содержит 50 заданий и состоит из части А (38 заданий) и части В (12 заданий). На выполнение всего теста отводится 150 минут. Необходимые справочные материалы – «Периодическая система химических элементов Д.И. Менделеева», «Растворимость кислот, оснований и солей в воде», Электрохимический ряд активности металлов» — приведены в конце теста.
При расчётах принять молярный объём газа (Vm) 22,4 дм3/моль. Значения относительных атомных масс химических элементов (кроме хлора, для которого Ar = 35,5) следует округлять до целого числа. При решении заданий можно пользоваться микрокалькулятором.
Часть А
Для получения приближённого значения чисел в промежуточных расчётах округлите их до третьего знака после запятой по правилам округления. Конечный результат округлите, ориентируясь на числа, предложенные в ответе.
В каждом задании только ОДИН из предложенных вариантов ответа является верным.
А1. Атом серы имеет:
а) агрегатное состояние; б) окраску;
в) массу; г) размеры.
1) а, в
2) а, г
3) а, б
4) б, в
5) в, г
А2. Для смеси НЕВЕРНО утверждение:
1) состоит из нескольких веществ
2) всегда однородна
3) содержит атомы разных химических элементов
4) некоторые смеси можно разделить фильтрованием
5) некоторые смеси можно разделить с помощью прибора, указанного на рисунке 
А3. Разный заряд ядра, но одинаковое число электронов имеют частицы:
А4. Три неспаренных электрона в основном состоянии содержит атом химического элемента:
1) Br
2) S
3) N
4) Al
5) Mg
А5. По отношению к элементам второго периода верны утверждения:
а) в атомах элементов отстутствуют d-орбитали;
б) высшая степень окисления атомов постепенно возрастает слева направо (без учёта Ne);
в) с ростом номера группы металлические свойства ослабевают, а неметаллические – возрастают;
г) образуют летучие водородные соединения.
1) б, в, г
2) а, б, в
3) а, б
4) а, в
5) в, г
А6. В составе иона MnO42- степень окисления атома марганца равна:
1) +2
2) +4
3) +6
4) +7
5) +8
А7. Низкая температура плавления и отсутствие электрической проводимости характерно для пары веществ, формулы которых:
1) O2 и Br2
2) C6H6 и K
3) Na2CO3 и Hg
4) N2 и Si
5) KOH и H2SO4
А8. Плотность (г/дм3, н.у.) углекислого газа равна плотности газа, формула которого:
1) NH3
2) CO
3) SO2
4) C2H4
5) C3H8
А9. Между собой реагируют высшие оксиды элементов с электронными конфигурациями атомов:
1) 1s22s1 и 1s22s22p63s23p4
2) 1s22s22p63s2 и 1s22s22p63s23p64s1
3) 1s22s22p2 и 1s22s22p63s23p3
4) 1s22s22p63s23p5 и 1s22s22p63s23p64s23d104p5
5) 1s22s22p2 и 1s22s22p3
А10. С NaОН (р-р) реагируют все вещества ряда:
1) HBr, K2CO3, SiO2
2) Cu(NO3)2, NH4Br, SO2
3) SrCl2, Zn(OH)2, HgO
4) KNO3, Al, Al(OH)3
5) FeCl2, KOH, H2SiO3
А11. Разбавленная серная кислота при комнатной температуре НЕ реагирует с веществом (минералом), название которого:
1) мрамор
2) поташ
3) кварц
4) гашёная известь
5) малахит
А12. Укажите справедливое утверждение для карбоната и гидрокарбоната магния:
1) соли разных кислот
2) реагируют с водным раствором гидроксида бария
3) имеют одинаковый качественный состав
4) реагируют с соляной кислотой
5) растворимы в воде
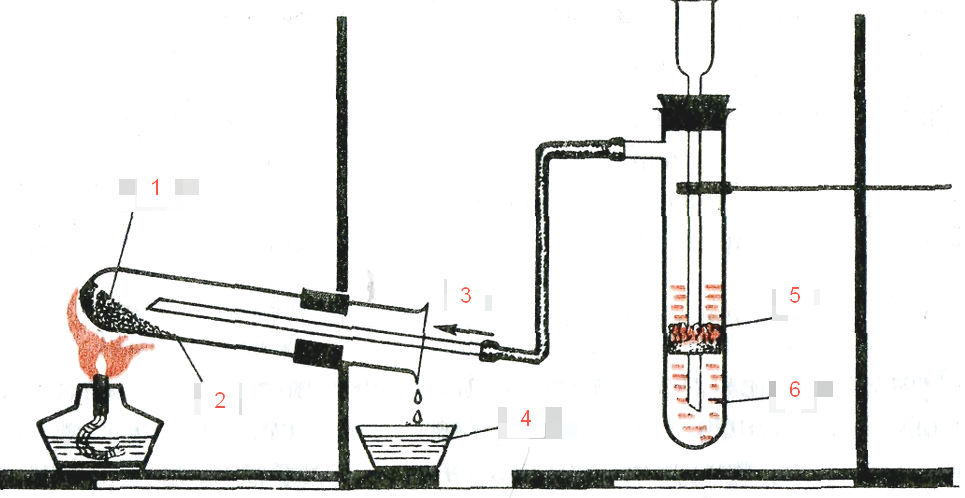
А13. Укажите формулы веществ, которые зашифрованы цифрами на рисунке:
1) 1 – CuO, 2 – Cu, 3 – H2, 4 – H2O, 5 – Cu, 6 – HNO3
2) 1 – CuO, 2 – Cu, 3 – H2, 4 – H2O, 5 – Zn, 6 – HCl
3) 1 – Na2O, 2 – Na, 3 – H2, 4 – H2O, 5 – Zn, 6 – HCl
4) 1 – CuO, 2 – Cu, 3 – H2O, 4 – H2, 5 – Fe, 6 – HCl
5) 1 – FeO, 2 – Fe, 3 – H2, 4 – H2O, 5 – Mg, 6 – NaOH
А14. Для галогенов и их соединений справедливы утверждения:
а) фтор в природе встречается в составе фосфорита;
б) простые вещества токсичны;
в) в ряду HF → HCl → HBr сила кислот возрастает;
г) в ряду HCl → HBr → HI восстановительные свойства соединений возрастают;
д) иод и бром можно получить по реакции их растворимых солей с хлором.
1) б, в, г, д
2) б, г
3) а, б, в, д
4) б, в, д
5) а, г, д
А15. Кислород – восстановитель в реакциях, схемы которых:
а) Na + O2 →;
б) NaNO3 → (t);
в) KMnO4 → (t);
г) FeS2 + O2 → (t).
1) а, в
2) а, б
3) б, в
4) б, г
5) а, г
А16. Из аммиака объёмом (н.у.) 7,84 дм3 с выходом 40% получили раствор азотной кислоты объёмом 200 см3. Молярная концентрация (моль/дм3) азотной кислоты в полученном растворе составляет:
1) 0,7
2) 0,35
3) 1,75
4) 4,41
5) 4,375
А17. Укажите число всех верных утверждений об использовании углекислого газа:
а) в пищевой промышленности;
б) в качестве антифриза;
в) для поддержания дыхания в медицине;
г) в качестве средства для тушения пожаров;
д) в качестве хладагента.
1) 1
2) 2
3) 3
4) 4
5) 5
А18. Укажите НЕВЕРНОЕ утверждение:
1) в реакции калия с кислородом может быть получен надпероксид калия КО2
2) гидроксид натрия разлагается при нагревании на оксид натрия и воду
3) литий реагирует с азотом при комнатной температуре
4) в реакции цезия с водой образуется газ
5) гидроксиды щелочных металлов окрашивают водный раствор лакмуса в синий цвет
А19. Выберите верные утверждения:
а) временную жёсткость воды можно устранить с помощью фосфата натрия;
б) окислительная способность ионов Ba2+ в водном растворе выше, чем ионов H+;
в) температура плавления простых веществ постепенно возрастает в ряду Ca → Fe → W;
г) цинк восстанавливается в реакции с раствором сульфата железа (II);
д) массовая доля железа в оксиде Y, полученного по схеме ![]() составляет 77,8%;
составляет 77,8%;
е) в реакции меди с концентрированной азотной кислотой образуется газ, который является несолеобразующим оксидом.
1) а, в, д, е
2) а, в, г, д
3) б, г, д, е
4) б, г, е
5) а, в, д
А20. К раствору массой 120 г с массовой долей K3[Al(OH)6] равной 20,5% прилили соляную кислоту массой 120 г с массовой долей HCl равной 9,125%. Массовая доля (%) растворенного вещества в растворе после реакции составляет:
1) 1,8
2) 3,25
3) 9,31
4) 9,63
5) 10,1
А21. Укажите тепловой эффект и тип реакции соответственно для взаимодействия водорода и кислорода с образованием воды на энергетической диаграмме, которая представлена на рисунке ниже, если Q1 = 1357,6 кДж и Q2 = 1929,2 кДж: 
1) 3286,8 кДж, экзотермическая
2) 1929,2 кДж, эндотермическая
3) 1929,2 кДж, экзотермическая
4) 571,6 кДж, эндотермическая
5) 571,6 кДж, экзотермическая
А22. В закрытом сосуде постоянного объёма протекает реакция 2А (г) + Б (г) = А2Б (г). Скорость расходования вещества А составляет 0,02 моль/(дм3∙с), а начальная концентрация вещества А2Б равна 0,4 моль/дм3. Концентрация (моль/дм3) вещества А2Б через 10 с после начала реакции будет равна:
1) 0,2
2) 0,38
3) 0,6
4) 0,42
5) 0,5
А23. Повысить растворимость газов в воде можно:
а) понизив температуру воды;
б) повысив внешнее давление;
в) активным перемешиванием воды;
г) повысив температуру воды.
1) а, в
2) а, б
3) б, в, г
4) а, б, в
5) б
А24. Между собой взаимодействуют водные растворы веществ:
а) NaOH (1 моль) и HBr (1 моль);
б) Ba(OH)2 (1 моль) и H2SO4 (1 моль);
в) Ca(OH)2 (1 моль) и HI (2 моль);
г) KOH (1 моль) и HF (1 моль).
Укажите число одинаковых сокращённых ионных уравнений реакций:
1) 0
2) 1
3) 2
4) 3
5) 4
А25. Отметьте схемы окислительно-восстановительных реакций:
а) SiH4 + O2 → SiO2 + H2O;
б) FeO + P → Fe + P2O5;
в) NaOH + SO2 → NaHSO3;
г) Na + H2 → NaH;
1) а, б
2) а, б, в, г
3) б, в
4) б, в, г
5) а, б, г
А26. Уравнение химической реакции ![]() соответствует процессу:
соответствует процессу:
1) перегонки
2) риформинга
3) дегидрирования
4) крекинга
5) ароматизации
А27. Укажите верные утверждения, характеризующие метан:
а) молекула неполярна;
б) один из продуктов хлорирования – хлороформ;
в) основной компонент попутного нефтяного газа;
г) реагирует с хлором и кислородм по типу замещения;
д) один из продуктов реакции сплавления пропионата натрия с гидроксидом натрия;
е) в смеси с воздухом взрывоопасен в объёмном отношении 1:10.
1) а, б, г, е
2) а, в, г, е
3) а, г, е
4) б, г
5) б, г, д, е
А28. Укажите названия веществ, представленных на рисунке соответственно :
1) цис-бутен-2, бутен-1, транс-бутен-2
2) бутен-1, бутан, цис-бутен-2
3) транс-бутен-2 , бутен-1, цис-бутен-2
4) бутен-1, бутан, бутин
5) цис-бутен-2, транс-бутен-2, бутен-1
А29. Валентный угол НСН возрастает в результате реакций, схемы которых:
а) этен + водород → этан;
б) C2H6 → C2H4 + H2;
в) CH3 – CH3 → CH≡CH + H2;
г) CH4 → H – C ≡ C – H + H2.
1) а, б
2) а, б, в
3) а, г
4) а, в, г
5) б, в, г
А30. Стирол, в отличие от бензола, реагирует с:
а) O2;
б) Br2/H2O;
в) HNO3/H2SO4;
г) H2O/H+;
д) KMnO4/H+;
е) HBr.
1) а, в
2) б, г, д, е
3) б, в, е
4) б, г, д
5) в, г, д, е
А31. Укажите пары веществ, продукты взаимодействия которых будут гомологами по отношению друг к другу:
а) этен и вода;
б) пропен и перманганат калия (водный р-р);
в) глицерин и бромоводород;
г) пропаналь и водород.
1) а, б
2) б, в
3) в, г
4) а, в
5) а, г
А32. Укажите формулы реагентов Х и Y соответственно в схеме превращений
1) H2O, NH3
2) HCl (p-p), HNO3
3) H2O, CH3COOH
4) HCl (p-p), Br2 (H2O)
5) H2SO4 (p-p), NaOH (p-p)
А33. Для качественного определения альдегидов можно использовать при нагревании тот же реактив, который используется для качественного определения:
1) этанола
2) фенола
3) этиленгликоля
4) этилена
5) бутадиена-1,3
А34. Массовая доля атомов углерода в молекуле гомолога муравьиной кислоты составляет 54,55%. Укажите количество изомеров с этой молекулярной формулой (с учётом межклассовых изомеров, но без учёта стериоизомеров):
1) 2
2) 3
3) 4
4) 5
5) 6
А35. Жидкие жиры вступают в реакции:
а) окисления;
б) гидрогалогенирования;
в) щелочного гидролиза;
г) присоединения водорода.
1) а, б, в, г
2) а, б, в
3) а, б, г
4) б, г
5) в, г
А36. В реакцию этерификации НЕ может вступать:
1) глюкоза
2) диацетилцеллюлоза
3) тринитроцеллюлоза
4) молочная кислота
5) сорбит
А37. Значения рН водных растворов последовательно возрастает в ряду соединений (молярные концентрации веществ равны):
1) анилин, метиламин, аммиак
2) аммиак, анилин, метиламин
3) метиламин, анилин, аммиак
4) анилин, аммиак, метиламин
5) аммиак, метиламин, анилин
А38. Амидные связи присутствуют в структуре каждого соединения в паре:
1) лавсан и найлон-6,6
2) кевлар и полистирол
3) капролактам и найлон-6,6
4) тефлон и кевлар
5) полибутадиен и поливинилхлорид
Часть В
При решении задач в промежуточных расчётах для получения приближенного значения чисел округлите их до третьего знака после запятой по правилам округления, а конечный результат – до целого числа. Единицы измерения числовых величин не указывайте.
Ответы, полученные при выполнении заданий, запишите в бланк ответов. Каждую букву, цифру пишите в отдельной клеточке (начиная с первой) по образцам, указанным в бланке.
В1. Вещество А, представляющее собой бесцветную жидкость с острым характерным запахом, неограниченно растворимую в воде, используется как консервант. В присутствии красного фосфора вещество А вступает в реакцию с хлором с образованием органического вещества Б и неорганического газообразного вещества В, которое реагирует с раствором нитрата серебра (I) с образованием белого творожистого осадка Г. При взаимодействии 1 моль вещества Б и 2 моль аммиака образуется органическое вещество Д, остатки которого входят в состав биологически важных веществ. Установите соответствии между буквой, которой зашифровано вещество, и молярной массой (г/моль) этого вещества.
| Вещество | Молярная масса (г/моль) |
| А
Б В Г Д |
1) 36,5
2) 143,5 3) 60 4) 75 5) 94,5 |
Ответ запишите в виде букв и цифр, например: А5Б1В6Г4Д2.
В2. Насыщенный спирт, содержащий одну функциональную группу, массой 120 г нагрели в присутствии концентрированной серной кислоты. В результате образовался газ объёмом 35,84 дм3 с выходом 80%. Этот газ пропустили через водный раствор перманганата калия. В результате образовался спирт с выходом 75%, содержащий несколько функциональных групп. Вычислите массу в г полученного спирта.
В3. Смесь фенола, уксусной и акриловой кислот общей массой 41,8 г растворили в воде и получили раствор массой 400 г. Для полной нейтрализации 10 г этого раствора потребовался раствор гидроксида натрия объёмом 9,52 см3 с массовой долей щёлочи 6% и плотностью 1,05 г/см3. При обработке 10 г такого же раствора бромной водой с массовой долей брома 3% до прекращения её обесцвечивания затратилось 66,65 г бромной воды. Рассчитайте массовую долю (%) уксусной кислоты в исходном растворе.
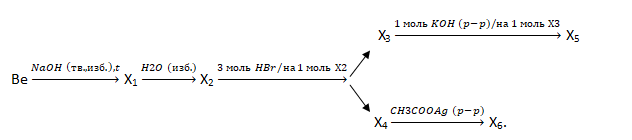
В4. Определите сумму молярных масс (г/моль) веществ Х5 и Х6, которые можно получить в результате следующих превращений (Х5 – неорганическое бериллийсодержащее вещество, Х6 – органическое натрийсодержащее вещество):
В5. Выберите три верных утверждения о этилформиате.
- Относится к простым эфирам.
- Продукт реакции этаналя и метановой кислоты.
- Изомер пропионовой кислоты.
- Реагирует с Cu(OH)2 при нагревании.
- Продуктом щелочного гидролиза является формалин.
- Другое название — этилметаноат.
В6. Дана схема превращений, в которой каждая химическая реакция обозначена буквой:
Для осуществления этих превращений выберите по одному реагенту на каждую реакцию из:
- CuO; 5. Ag2O (NH3 p-p);
- P2O5; 6. H2O;
- Дрожжи; 7. AgNO3;
- H3PO4; 8.CH3OH;
Ответ запишите в виде сочетания букв и цифр, например А4Б1В2Г3Д5.
В7. Установите соответствие между парой веществ, которые находятся в разных пробирках, и реагентом, с помощью которого можно их различить (с соблюдением условий).
| Пары веществ | Реагент и условия |
| А) пропанол-1 и пропандиол-1,2
Б) муравьиная и масляная кислота В) мальтоза и сахароза Г) бензол и фенол |
1) K2CO3 (p-p)
2) фенолфталеин (p-p) 3) Ag2O/NH3, H2O, t 4) Cu(OH)2, 20C 5) FeCl3 (p-p) |
Ответ запишите в виде последовательности букв и цифр, например А4Б2В2Г3. Помните, что некоторые реагенты могут использоваться несколько раз, а некоторые не использоваться вообще.
В8. Выберите четыре утверждения, которые верно характеризуют фосфор.
- Реагирует с водородом с образованием газа фосфина.
- Одна из аллотропных модификаций имеет чесночный запах.
- Молекула белого фосфора имеет форму октаэдра.
- Одна из аллотропных модификаций легкоплавка летуча.
- Химически более активен, чем азот.
- В атоме в основном состоянии содержится три неспаренных электрона.
В9. Рассчитайте массу (г) гидросульфата аммония, которую необходимо добавить к гидросульфиту калия массой 3,6 г, чтобы получилась смесь, содержащая равное число атомов водорода и кислорода.
В10. Растворимость безводного карбоната натрия при некоторой температуре составляет 31,8 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната натрия к 400 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора сульфата железа(III). К раствору во второй колбе добавили 300 г раствора азотной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался в 2 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю (%) нитрата натрия в конечном растворе во второй колбе.
В11. В смеси простых газообразных веществ содержится одинаковое число атомов азота, гелия и кислорода. Вычислите массу (г) этой смеси, имеющей объём 5 дм3 (н.у.).
В12. Балончик для заправки зажигалок содержит 80 г жидкой пропан-бутановой смеси, которая находится под давлением и занимает объём 150 см3. Определите количество теплоты (МДж), которая выделится при полном сгорании в кислороде всего содержимого это балончика, использая данные из таблицы ниже. А также примите, что объём жидкой смеси равен сумме объёмов чистых жидких углеводородов.
Ответы:
Часть А
- 5
- 2
- 4
- 3
- 4
- 3
- 1
- 5
- 1
- 2
- 3
- 4
- 2
- 1
- 3
- 1
- 3
- 2
- 5
- 4
- 5
- 5
- 2
- 3
- 5
- 4
- 1
- 5
- 5
- 2
- 5
- 2
- 3
- 5
- 1
- 3
- 4
- 3
Часть В
- А3Б5В1Г2Д4
- 91
- 5
- 125
- 346
- А6Б3В1Г5Д2
- А4Б3В3Г5
- 2456
- 7
- 22
- 4
- 4
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
Посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»
- Посмотреть все пробные варианты ЦТ вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Больше заданий РТ вы можете найти здесь, нажав на эту строку
- Больше заданий ЦТ вы можете найти здесь, нажав на эту строку