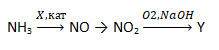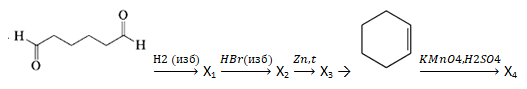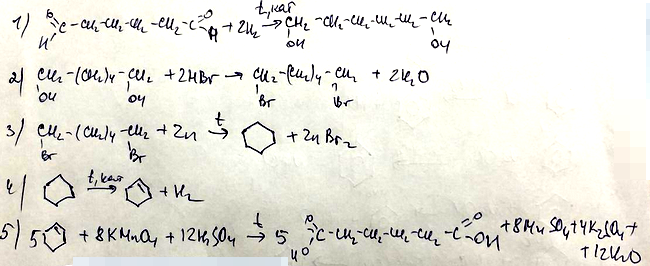Скачать Пробный вариант 8. ЕГЭ 2020 по химии с ответами в формате pdf
Вариант 8
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
1) C; 2) S; 3) Al; 4) P; 5) Zn.
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
- Определите, простые анионы каких из указанных элементов в основном состоянии имеют конфигурацию внешнего электронного слоя 3s23p6. Запишите в поле ответа номера выбранных элементов.
- Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения способности их атомов притягивать электроны. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
- Из числа указанных в ряду элементов выберите два элемента, которые способны образовывать только один оксид. Запишите в поле ответа номера выбранных элементов.
- Из предложенного перечня выберите два «пропуска», которые необходимо вставить в предложение: Из веществ – вода, сероводород – наибольшую температуру кипения имеет … , так как имеет … .
1) H2O
2) H2S
3) водородные связи между молекулами
4) большую длину связи
5) меньшую длину связи
Запишите в поле ответа номера выбранных «пропусков».
- Установите соответствие между формулой вещества и его тривиальным названием: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ТРИВИАЛЬНОЕ НАЗВАНИЕ |
| А) NH4Cl | 1) нашатырь |
| Б) Fe3O4 | 2) веселящий газ |
| В) NO2 | 3) бурый газ |
| 4) магнитный железняк |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует вода с образованием основания.
1) магний
2) медь
3) железо
4) натрий
5) хлор
Запишите в поле ответа номера выбранных веществ.
- Порцию олеума растворили в избытке воды и образовавшийся раствор разлили в две пробирки. В одну из пробирок добавили растворимое в воде вещество Х, а в другую – нерастворимое в воде вещество Y. В результате чего в первой пробирке наблюдали образование осадка, а во второй – полное растворение добавляемого вещества с образованием раствора голубого цвета и появлением пузырьков газа без цвета и запаха. Из предложенного перечня выберите вещества Х и Y, которые могут вступать в описанные реакции.
1) нитрат магния
2) карбонат меди (II)
3) гидроксид меди (II)
4) гидроксид бария
5) оксид натрия
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
- Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) N2 | 1) K2CO3, Ba(OH)2, K2S |
| Б) CuO | 2) Fe(OH)3, NaOH, H2SO4 |
| В) HCl | 3) NH3, HI, Cu |
| Г) Al2(SO4)3 | 4) Mg, NaBr, KOH |
| 5) Li, H2, O2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) железо и иод | 1) иодид железа (II) |
| Б) железо и иодоводородная кислота | 2) иодид железа (III) |
| В) оксид железа (II) и иодоводородная кислота | 3) иодид железа (II) и водород |
| Г) оксид железа (III) и иодоводородная кислота | 4) иодид железа (II) и вода |
| 5) иодид железа (III) и вода | |
| 6) иодид железа (II), иод и вода |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) NaNO3
2) NaNO2
3) O2
4) H2O
5) HNO3
Запишите в таблицу номера веществ под соответствующими буквами.
- Установите соответствие между названием вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
| А) м-ксилол
Б) цистеин В) неопентан |
1) спирты
2) амины 3) аминокислоты 4) углеводороды |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два типа гибридизации атомных орбиталей, которые характерны для атомов углерода, содержащихся в молекуле 2-метилпентена-2.
1) sp3
2) sp2
3) sp
4) sp3d2
5) атомные орбитали не гибридизованы
Запишите в поле ответа номера выбранных типов гибридизации.
- Из предложенного перечня выберите два вещества, каждое из которых при взаимодействии с магнием образует циклопарафин.
1) 1,3-дихлорпропан
2) 1,2-дихлорпропан
3) 2,3-дибромбутан
4) 1,4-дибромбутан
5) 1,2-дибромбутан
Запишите в поле ответов номера выбранных веществ.
- Из предложенного перечня выберите два вещества, которые образуются при щелочном гидролизе сложного эфира, который является изомером бутановой кислоты.
1) C2H5OK
2) CH3COOK
3) CH3CH2OH
4) C4H9OH
5) HCOOH
Запишите в поле ответа номера выбранных веществ.
- Из предложенного перечня выберите два вещества, из которых в одну стадию можно получить амин.
1) нитробензол
2) глицин
3) пропаналь
4) этанол
5) сахароза
Запишите в поле ответа номера выбранных веществ.
- Установите соответствие между реагирующими веществами и углеродсодержащим продуктом их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТ ВЗАИМОДЕЙСТВИЯ |
| А) Al4C3 + HBr → | 1) CH4 |
| Б) C2H4Cl2 + KOH (спирт. р-р) → | 2) CH2=CH2 |
| В) CH3Cl + Na → | 3) CH3-CH2-OH |
| Г) C2H4Cl2 + Mg → | 4) HC≡CH |
| 5) CH3-CH3 | |
| 6) C2H4(OH)2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между схемой реакции и органическим продуктом Х, которое преимущественно образуется в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) С6H12O7
2) C6H14O6
3) C12H22O11
4) H2O (H+)
5) H2SO4 (конц.)
Запишите в таблицу номера веществ под соответствующими буквами.
- В колбу, содержащую чёрный порошок оксида меди (II) пропустили ток водорода при нагревании до полного покраснения, а затем охладили и добавили избыток концентрированной азотной кислоты.
Из предложенного перечня типов реакций выберите два типа реакций, которые НЕ протекали в ходе эксперимента.
1) замещения
2) окислительно-восстановительная
3) необратимая
4) гомогенная
5) нейтрализации
Запишите в поле ответа номера выбранных типов реакций.
- Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению скорости реакции бензола с хлором в присутствии хлорида алюминия.
1) удаление хлорида алюминия
2) повышение температуры
3) удаление хлорбензола из реакционной смеси
4) добавление воды
5) уменьшение давления
Запишите в поле ответа номера выбранных внешних воздействий.
- Установите соответствие между схемой перехода и количеством отданных/принятых электронов в результате этого перехода: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА ПЕРЕХОДА | КОЛИЧЕСТВО ЭЛЕКТРОНОВ |
| А) 2O-1 → O20 | 1) -10e— |
| Б) O2 → 2O-2 | 2) -2e— |
| В) Cr2O72- → 2Cr3+ | 3) +4e— |
| 4) +6e— |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названием вещества и условиями его получения электролизом с инертными электродами: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | УСЛОВИЯ ПОЛУЧЕНИЯ ЭЛЕКТРОЛИЗОМ |
| А) натрий | 1) раствор NaF |
| Б) фтор | 2) расплав NaF |
| В) золото | 3) раствор AlCl3 |
| Г) алюминий | 4) раствор AuCl3 |
| 5) раствор NaCl | |
| 6) расплав AlCl3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названием соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
| А) фторид ртути (II) | 1) гидролизуется по катиону |
| Б) хлорид бериллия | 2) гидролизуется по аниону |
| В) нитрит натрия | 3) гидролизу не подвергается |
| Г) перхлорат калия | 4) гидролизуется по катиону и аниону |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между внешним воздействием на систему 4NH3 (г) + 5O2 (г) ↔ 4NO (г) + 6H2O (г) + Q, и смещением химического равновесия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) повышение температуры | 1) смещается в сторону прямой реакции |
| Б) понижение давления | 2) смещается в сторону обратной реакции |
| В) повышение концентрации аммиака | 3) практически не смещается |
| Г) удаление оксида азота (II) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названиями вещества и реагента, который можно использовать для качественного определения этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВА | РЕАГЕНТ |
| А) пропановая кислота | 1) I2 (спиртовой р-р) |
| Б) анилин | 2) Br2/H2O |
| В) крахмал (клейстер) | 3) K2SiO3 (p-p) |
| Г) глюкоза | 4) KNO3 (p-p) |
| 5) KOH (p-p) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названием полимера и его типом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ПОЛИМЕР | ТИП ПОЛИМЕРА |
| А) капрон | 1) природный |
| Б) хлопок | 2) искусственный |
| В) нейлон | 3) синтетический |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Вычислите массовую долю (в %) сульфата меди (II) в растворе, полученном при растворении медного купороса (CuSO4∙5H2O) количеством 0,25 моль в 250 г воды. (Запишите число с точностью до десятых.)
- В реакции алюминия массой 0,27 г с избытком кислорода выделилось 16 кДж теплоты. Вычислите тепловой эффект (в кДж) реакции образования одного моля оксида алюминия. (Запишите число с точностью до целых.)
- Вычислите минимальный объём углекислого газа, который можно растворить в 80 г гидроксида натрия. (Запишите число с точностью до десятых.)
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
карбонат калия, хлорид железа (III), хлорид калия, оксид калия, иодоводород, медь. Допустимо использование водных растворов веществ.
- Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора в виду образования осадка. Выделение газа в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
- Из предложенного перечня веществ выберите две соли, которые вступают в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
- Сульфат бария смешали с коксом и прокаливают. При обработке продукта прокаливания хлороводородной кислотой выделяется газ с запахом тухлых яиц, который затем пропускают через раствор перманганата калия подкисленный серной кислотой. В результате образуется простое вещество, которое не растворимо в воде и её не смачивается. Его выделяют и раствора и обрабатывают концентрированной серной кислотой. Напишите уравнения четырёх описанных реакций.
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
- При полном разложении при невысокой высокой температуре 54 г смеси нитрита, нитрата и дихромата аммония получено 15,2 г твёрдого осадка. При этом выделилось 11,2 л газа (н.у.). Определите массовую долю нитрата аммония в исходной смеси. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических венличин).
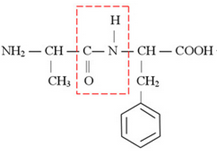
- В состав органического вещество входит 6,78% водорода, 20,34% кислорода и 11,86% азота по массе. Это вещество подвергается гидролизу с образованием двух веществ, одно из которых является производным первого, в котором один атом водорода замещён фенильной группой. Известно, что одно из веществ, образующихся при гидролизе имеет очень важную биологическую функцию и является незаменимым для организма человека.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение гидролиза вещества в присутствии кислоты (используйте структурные формулы органических веществ).
Система оценивания экзаменационной работы по химии
Часть 1
За правильный ответ на каждое из заданий 1–6, 11–15, 19–21, 26–29 ставится 1 балл.
Задание считается выполненным верно, если экзаменуемый дал правильный ответ в виде последовательности цифр или числа с заданной степенью точности.
Задания 7–10, 16–18, 22–25 считаются выполненными верно, если правильно указана последовательность цифр.
За полный правильный ответ заданий 7–10, 16–18, 22–25 ставится 2 балла; если допущена одна ошибка – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
| Номер задания | Правильный ответ |
| 1 | 24 |
| 2 | 243 |
| 3 | 35 |
| 4 | 13 |
| 5 | 143 |
| 6 | 14 |
| 7 | 42 |
| 8 | 5311 |
| 9 | 1146 |
| 10 | 31 |
| 11 | 434 |
| 12 | 12 |
| 13 | 14 |
| 14 | 23 |
| 15 | 14 |
| 16 | 1452 |
| 17 | 3115 |
| 18 | 42 |
| 19 | 45 |
| 20 | 23 |
| 21 | 234 |
| 22 | 2246 |
| 23 | 4123 |
| 24 | 2111 |
| 25 | 3212 |
| 26 | 313 |
| 27 | 12,8 |
| 28 | 1600 |
| 29 | 22,4 |
Часть 2
Критерии оценивания заданий с развёрнутым ответом
За выполнение заданий 30, 31 ставится от 0 до 2 баллов; задания 35 – от 0 до 3 баллов; заданий 32 и 34 – от 0 до 4 баллов; задания 33 – от 0 до 5 баллов.
Задание 30
Вариант ответа:
2FeCl3 + 6HI → 2FeI2 + I2↓ + 6HCl
2 Fe+3 + ē → Fe+2
1 2I— – 2ē → I20
Иодоводород или иод в степени окисления -1 является восстановителем.
Хлорид железа (III) или железо в степени окисления +3 – окислителем
Задание 31
Вариант ответа:
2FeCl3 + 3K2CO3 + 3H2O = 6KCl + 2Fe(OH)3 + 3CO2
2Fe3+ + 6Cl— + 6K+ + 3CO32- + 3H2O = 6K+ + 6Cl— + 2Fe(OH)3 + 3CO2
2Fe3+ + 3CO32- + 3H2O = 2Fe(OH)3 + 3CO2
Задание 32
Вариант ответа:
BaSO4 + 4C = BaS + 4CO
BaS + 2HCl = BaCl2 + H2S
5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
S + 2H2SO4 (конц) = 3SO2 + 2H2O
Задание 33
Примечание. Допустимо использование структурных формул разного вида (развёрнутой, сокращённой, скелетной), однозначно отражающих порядок связи атомов и взаимное расположение заместителей и функциональных групп в молекуле органического вещества.
Задание 34
Объяснение этой задачи вы можете найти на Ютуб по ссылке
Ответ: 29,6%
Задание 35
Найдём массовую долю углерода, так как в состав всех органических соединений входит углерод.
w (C) = 100% — 6,78% — 20,34% — 11,86% = 61,02%
Найдем соотношение количества вещества углерода, водорода, кислорода и азота.
Примем массу соединения за 100 грамм, тогда количество вещества элементов следующее:
n (С) = 61,02 г/12 г/моль = 5,085 моль
n (H) = 6,78 г/1 г/моль = 6,78 моль
n (O) = 20,34 г/16 г/моль = 1,271 моль
n (N) = 11,86 г/14 г/моль = 0,847 моль
Соотношение углерода к водороду, кислороду и азоту 5,085 : 6,78 : 1,271 : 0,847 = 6 : 8 : 1,5 : 1= 12 : 16 : 3 : 2
Молекулярная формула вещества C12H16O3N2
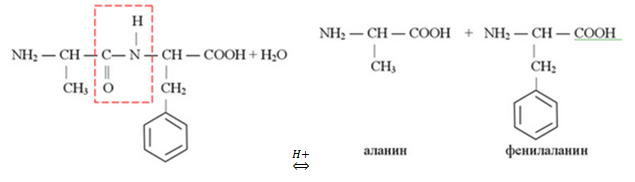
Анализируя рописание вещества, делаем вывод, что исходное вещество – дипептид аланина и незаменимой аминокислоты фенилаланина, которое и является производным аланина.
Уравнение кислотного гидролиза:
Также вы можете скачать:
- Пробный вариант №1 ЕГЭ 2020 г. (аналог демонстрационного варианта ЕГЭ 2020 г.) с ответами в формате pdf
- Пробный вариант 2. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 3. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 4. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 5. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 6. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 7. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 8. ЕГЭ 2020 по химии с ответами в формате pdf
- Демонстрационный вариант ЕГЭ 2020 (с сайта ФИПИ)
- Кодификатор ЕГЭ 2020 (с сайта ФИПИ)
- Спецификация ЕГЭ 2020 (с сайта ФИПИ)
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку