Предлагаем вашему вниманию седьмой пробный вариант для подготовки к ЦТ по химии 2019.
Скачать РТ 2018/2019 вариант 7
Вариант 7
Вариант содержит 50 заданий и состоит из части А (38 заданий) и части В (12 заданий). На выполнение всего теста отводится 150 минут. Необходимые справочные материалы – «Периодическая система химических элементов Д.И. Менделеева», «Растворимость кислот, оснований и солей в воде», Электрохимический ряд активности металлов» — приведены в конце теста.
При расчётах принять молярный объём газа (Vm) 22,4 дм3/моль. Значения относительных атомных масс химических элементов (кроме хлора, для которого Ar = 35,5) следует округлять до целого числа. При решении заданий можно пользоваться микрокалькулятором. Будьте внимательны! Желаем успеха!
Часть А
Для получения приближённого значения чисел в промежуточных расчётах округлите их до третьего знака после запятой по правилам округления. Конечный результат округлите, ориентируясь на числа, предложенные в ответе.
В каждом задании только ОДИН из предложенных вариантов ответа является верным. В бланке ответов под номером задания поставьте метку (х) в клеточке, соответствующей номеру выбранного варианта ответа.
А1. Число протонов в атоме 39К равно:
1) 39 2) 20 3) 19 4) 4
А2. Название химического элемента, имеющего электронную конфигурацию атома в основном состоянии 1s22s22p63s23p63d104s24p64d105s25p66s2:
1) стронций (Sr) 2) цезий (Cs)
3) барий (Ba) 4) радий (Ra)
А3. Набор, в котором перечислены только те элементы, атомы которых содержат четное число электронов:
1) кислород, титан, стронций 2) калий, кальций, скандий
3) бор, углерод, алюминий 4) железо, кобальт, никель
А4. Укажите верное утверждение относительно элемента, атом которого имеет электронную конфигурацию 1s22s22p63s23p3:
1) является металлом
2) простое вещество состоит только из одноатомных молекул
3) имеет постоянную валентность
4) образует несколько простых веществ
А5. Тремя общими электронными парами образована ковалентная связь в молекуле:
1) азота 2) сероводорода 3) метана 4) хлора
А6. Атом азота проявляет одинаковую степень окисления в каждом из двух соединений:
1) NH3, N2O3 2) HNO2, Li3N 3) Mg3N2, NH3 4) NH3, HNO2
А7. Влажную смесь газов O2, HI, H2S, HCl, Cl2 пропустили через склянку с H2SO4 (конц.). В результате произошло:
1) осушение всех газов
2) поглощение всех газов
3) осушение газов O2, HCl и Cl2, поглощение газов HI и H2S
4) осушение газов HI и H2S, поглощение газов O2, HCl и Cl2
А8. Количество (моль) атомов водорода в аммиаке, объёмом (н.у.) 32,48 дм3, равно:
1) 1,45 2) 4,35 3) 5,8 4) 26,187
А9. Амфотерным оксидом является:
1) ВаО 2) Li2O 3) Аl2O3 4) MgO
А10. При добавлении щёлочи по каплям к разбавленному раствору соли происходит образование осадка, а затем его растворение. Укажите название соли:
1) гидрокарбонат кальция 2) хлорид железа (II)
3) нитрат натрия 4) сульфат цинка
А11. Укажите, сколько веществ, формулы которых могут реагировать с разбавленной соляной кислотой:
1) 7 2) 6 3) 5 4) 4
А12. Для карбоната калия не характерно взаимодействие в растворе с:
1) хлоридом кальция
2) сульфатом бария
3) оксидом углерода (IV)
4) азотной кислотой
А13. Установите соответствие между химическим элементом и агрегатным состоянием при н.у. простого вещества, образованного этим элементом:
| Элемент | Агрегатное состояние |
| 1) Ar
2) P 3) N 4) Br |
а) жидкость
б) газ в) твёрдое вещество |
1) 1а, 2а, 3б, 4б 2) 1а, 2б, 3в, 4в
3) 1б, 2б, 3в, 4а 4) 1б, 2в, 3б, 4а
А14. Хлороводород в лаборатории можно получить:
а) кипячением хлорной воды;
б) обработкой пиролюзита МnO2 соляной кислотой;
в) обработкой КСl концентрированной H2SO4;
г) хлорированием некоторых органических соединений;
д) действием H2SO4 (конц.) на хлориды металлов;
1) а, б, г 2) а, в, д 3) б, г, д 4) в, г, д
А15. Выберите справедливые утверждения для кислорода:
а) в виде простого вещества кислород содержится в атмосфере;
б) степень окисления атома кислорода минимальная в составе OF2;
в) кислород можно обнаружить с помощью щёлочи;
г) плотность простого вещества при н.у. составляет 1,43 г/дм3.
1) а, б 2) а, г 3) б, в 4) а, в
А16. Укажите справедливые утверждения для элементов VIA-группы:
а) с увеличением атомного номера возрастает число электронных слоев в атоме
б) энергия связи в водородных соединениях с увеличением заряда ядра атома уменьшается
в) кислотныя свойства оксидов состава ЭО3 с увеличением атомного номера элемента усиливается
г) кислотные свойства водородных соединений состава Н2Э с увеличением заряда ядра атома ослабевают
1) а, б 2) а, в 3) б, в 4) б, г
А17. Гидроксид алюминия в лаборатории можно получить:
а) спеканием Аl2O3 с едким натром;
б) действием раствора аммиака на Аl2(SO4)3;
в) обработкой АlСl3 раствором Na2S;
г) по реакции в растворе Аl(NО3)3 + NaOH (избыток);
д) пропусканием в раствор Na[Al(OH)4] углекислого газа;
1) а, б, д 2) а, в, г 3) а, г, д 4) б, в, д
А18. Накипь можно удалить с помощью:
1) кислоты 2) поваренной соли
3) щёлочи 4) воды
А19. Жёсткость воды повысится при растворении в ней:
1) гидрокарбоната магния 2) карбоната кальция
3) хлорида калия 4) гидрокарбоната натрия
А20. НЕВЕРНЫ утверждения:
а) атомы щелочноземельного металла входят в состав карналлита;
б) металлы образуют сплавы только с другими металлами и не образуют сплавы с неметаллами;
в) только восстановительными свойствами обладают атомы Са и ионы Са²+;
г) при одинаковых массовых долях рН раствора КОН больше, чем раствора NaOH (плотность растворов одинакова).
1) а, б, в 2) а, б, в, г 3) б, в, г 4) а, б, г
А21. Согласно термохимическому уравнению реакции ![]() укажите теплоту (кДж) обезвоживания кристаллогидрата массой 10 г:
укажите теплоту (кДж) обезвоживания кристаллогидрата массой 10 г:
1) +89,8 2) +196,7 3) -89,8 4) – 196,7
А22. Коэффициент перед продуктом восстановления в уравнении реакции, протекающей по схеме K2Cr2O7 + NaI + H2SO4 → I2 + Cr2(SO4)3 + Na2SO4 + K2SO4 + H2O, равен:
1) 1 2) 2 3) 3 4) 4
А23. Сместить равновесие процесса Cu2+ (р-р) + Н2О (ж) ↔ CuOH+ + H+ — Q вправо можно:
а) если подкислить раствор; б) добавить в раствор немного щёлочи;
в) повысить температуру; г) понизить температуру;
1) а, в 2) а, г 3) б, в 4) б, г
А24. Выберите из перечня верные утверждения:
а) при растворение разрушаются связи между частицами вещества, что требует затрат энергии;
б) при растворение происходит образование связей между частицами растворённого вещества и растворителя, которое сопровождаеться выделением энергии;
в) при растворении серной кислоты в воде происходит сильное охлаждение раствора;
г) на растворимость вещест температура не влияет;
д) растворимость — это число граммов вещества, которое можно максимально растворить при данной температуре в 100г воды;
1) а, б, в 2) а, в, г 3) а, б, д 4) б, в, г
А25. При диссоциации ортофосфорной кислоты по второй ступени образуются ионы
1) H+ и PO43− 2) H+ и HPO42−
3) H+ и H2PO4− 4) H2PO4−и HPO42−
А26. В растворе, рН которого равен 12, в больших количествах НЕ могут присутствовать ионы:
а) калия; б) аммония; в) стронция; г) магния.
1) а, в 2) а, б, г 3) б, в 4) б, г
А27. Модель молекулы ароматического углеводорода изображена на рисунке:
А28. При взаимодействии пропина с избытком хлороводорода получится преимущественно:
1) 1,2-дихлорпропан 2) 1,1-дихлорпропан
3) 2,2-дихлорпропан 4) 1,3-дихлорпропан
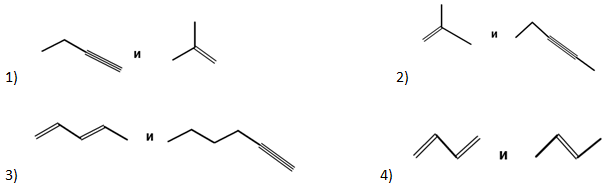
А29. Укажите пару веществ, при полном гидрировании которых образуются изомеры:
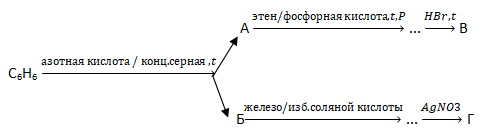
А30. В цепи превращений веществом Z является: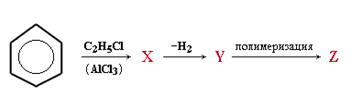
1) полипропилен 2) полистирол
3) поливинилхлорид 4) натуральный каучук
А31. Этанол не реагирует с:
1) Na 2) CuO 3) HCOOH 4) CuSO4
А32. При нитровании фенола массой 18,8 г получена пикриновая кислота массой 38,93 г. Выход реакции (%):
1) 80 2) 85 3) 90 4) 95
А33. Ацетальдегид взаимодействует с веществами:
а) бензол; б) водород; в) азот; г) гидроксид меди (II); д) кислород; е) пропан;
1) а, в, е 2) б, в, д 3) б, г, д 4) г, д, е
А34. Выберите верное утверждение:
1) карбоновые кислоты не взаимодействуют с галогенами;
2) в карбоновых кислотах не происходит поляризации связи О–Н;
3) галогензамещенные карбоновые кислоты уступают по силе негалогенированным аналогам;
4) галогензамещенные карбоновые кислоты более сильные, чем соответствующие карбоновые кислоты.
А35. Укажите массу (г) глюкозы, которая потребуется для брожения, чтобы получить спирт в количестве, достаточном для этерефикации уксусной кислоты массой 3,6 г:
1) 5,4 2) 6,8 3) 10,8 4) 18,0
А36. Вещество, формула которого CH3-NH-CH3:
а) хорошо растворяется в воде; б) горит с выделением азота;
в) реагирует с ССl4; г) реагирует с СН4;
д) содержит азот в степени окисления +3; е) проявляет основные свойства;
1) а, б, д 2) а, б, е 3) б, в, г 4) б, д, е
А37. Укажите, какие из приведенных формул органических веществ относятся к аминокислотам: 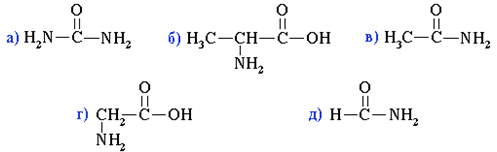
1) а, в 2) а, д 3) б, г 4) в, д
А38. При неполном гидролизе белка продуктом реакции может быть:
1) дипептид 2) глюкоза 3) дисахарид 4) глицерин
Часть В
При решении задач в промежуточных расчётах для получения приближенного значения чисел округлите их до третьего знака после запятой по правилам округления, а конечный результат – до целого числа.
Единицы измерения числовых величин не указывайте.
Ответы, полученные при выполнении заданий, запишите в бланк ответов. Каждую букву, цифру пишите в отдельной клеточке (начиная с первой) по образцам, указанным в бланке.
В1. К раствору вещества А (ляпис) был добавлен раствор гидроксида натрия. Образовался осадок Б, который отфильтровали, высушили и поместили в раствор аммиака, в результате чего получилось комплексное соединение. После прибавления к комплексному соединению альдегида В и последующего нагревания, образовался осадок вещества Г. Рассчитайте сумму молярных (г/моль) веществ А, В и Г, если известно, что в состав одной молекулы альдегида входит 2 атома углерода.
В2. Из предложенного списка выберите общие признаки, характерные для крахмала и целлюлозы:
- Синтезируются в растениях.
- Это полимеры, молекулы которых имеют большую молекулярную массу.
- Общая формула (С6Н10О5)n.
- Это линейные полимеры.
- При гидролизе образуется лактоза и фруктоза.
- Хорошо растворимы в воде.
Ответ запишите в виде последовательности цифр по порядку, например: 235.
В3. Для омыления триглецерида низшей предельной монокарбоновой кислоты массой 26 г потребовался раствор щёлочи объёмом 49,2 см3 с массовой долей гидроксида натрия 20% с плотностью 1,22 г/см3. Укажите молярную массу (г/моль) карбоновой кислоты, которой образован триглецирид.
В4. Найдите сумму молярных масс (г/моль) органических веществ В и Г, полученных в результате превращений (А – неорганическое вещество):
В5. Дан перечень веществ: алмаз, гидроксид стронция, кварц, кальцит, калиевая селитра, сернистый газ, хлор, фторид аммония. Укажите число высших оксидов, растворимых оснований, солей и простых веществ соответственно. Ответ запишите цифрами, соблюдая полученную последовательность, например 1014.
В6. Укажите молярную массу (г/моль) минерала, состав которого может быть представлен в виде оксидов калия, алюминия и кремния. Причём массовые доли оксида калия и алюминия равны соответственно 16,6 и 18,5%.
В7. Дана схема превращений ![]() Укажите вещества А-Д из предложенных:
Укажите вещества А-Д из предложенных:
- – O2. 2. – SO2. 3. – H2S. 4. – FeS. 5. – S. 6. – H2SO4.
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность, например А2Б1В3Г5Д4.
В8. Установите соответствие между названием вещества и названием реактива, с помощью которого можно обнаружить данное вещество (все вещества взяты в виде разбавленных водных растворов).
| Название вещества | Название реактива |
| А) иодид аммония
Б) серная кислота В) гидрокарбонат натрия Г) хлорид меди (II) |
1) нитрат бария
2) сульфат натрия 3) гидроксид калия 4) соляная кислота |
Ответ запишите в виде А2Б2В1Г4.
В9. Имеются две колбы. В одной находится раствор, полученный растворением в воде кристаллогидрата сульфата железа (II) массой 4,17 г, в другой – бромная вода, в которую пропускали сернистый газ до обесцвечивания раствора, на что потребовался SO2 объёмом 336 см3 (н.у.), причём в результате реакции образовалось две кислоты. Затем в обе колбы добавили избыток раствора хлорида бария, причём массы осадков в двух колбах оказались одинаковыми. Укажите число молекул воды, содержащихся в одной формульной единице исходного кристаллогидрата.
В10. Найдите сумму молярных масс (г/моль) бериллийсодержащих веществ Г и Е, образовавшихся в результате превращений:
В11. При полном сгорании 1 моль уротропина (сухое горючее) С6Н12N4 в избытке кислорода выделяется 4212 кДж тепла. Определите, сколько тепла (кДж) выделится, если для сжигания использовано 5,6 дм3 кислорода (н.у.) и соответствующее количество уротропина.
В12. В растворе массой 50 г с массовой долей HCl 12% некоторое время выдерживали пластинку массой 4 г, изготовленную из металла, который растворяется в соляной кислоте с образованием ионов Me2+. При этом масса пластинки уменьшилась на 42% и выделился газ объёмом 672 см3 (н.у.). Определите массовую долю (%) HCl в растворе после реакции.
Ответы:
Часть А
- 3
- 3
- 1
- 4
- 1
- 3
- 3
- 2
- 3
- 4
- 3
- 2
- 4
- 4
- 2
- 1
- 4
- 1
- 1
- 2
- 3
- 1
- 3
- 3
- 2
- 4
- 4
- 3
- 1
- 2
- 4
- 2
- 3
- 4
- 1
- 2
- 3
- 1
Часть В
- 322
- 123
- 74
- 265
- 1132
- 556
- А2Б3В5Г4Д6
- А3Б1В4Г3
- 7
- 252
- 117
- 7
Если вы заметили ошибку в условии или ответах, то просьба сообщить об этом Александру Конькову в контакт https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
- Посмотреть все пробные варианты РТ 2018/2019 вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку