Скачать Пробный вариант 3. ЕГЭ 2020 по химии с ответами в формате pdf
Вариант 3
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
1) Cu; 2) P; 3) Zn; 4) K; 5) Cl.
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
- Определите, атомы каких из указанных элементов в основном состоянии имеют электронную конфигурацию внешнего энергетического уровня 4s1. Запишите в поле ответа номера выбранных элементов.
- Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения активности их простых веществ. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
- Из числа указанных в ряду элементов выберите два элемента, которые могут проявлять отрицательную степень окисления в соединениях. Запишите в поле ответа номера выбранных элементов.
- Из предложенного перечня выберите два(-е) класса/группы веществ, для которых характерен ионный тип кристаллической решётки.
1) кислоты
2) металлы
3) неметаллы
4) соли
5) основные оксиды
Запишите в поле ответа номера выбранных классов/групп веществ.
- Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА |
| А) NaOH | 1) соли средние |
| Б) Cu(OH)2 | 2) щёлочи |
| В) (CuOH)2CO3 | 3) основания нерастворимые |
| 4) соли основные |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует медь.
1) разбавленная серная кислота
2) концентрированная серная кислота
3) селен
4) вода
5) сульфат цинка
Запишите в поле ответа номера выбранных веществ.
- Имеется две пробирки, в одной из которых находится вещество Х, а в другой – вещество Y. В обе пробирки добавили раствор серной кислоты. В результате чего в первой пробирке протекала реакция, фрагмент сокращённого ионного уравнения которой … = 2Na+ + H2O. Во торой пробирке также протекала реакция, которая описывается сокращённым ионным уравнением H+ + OH— = H2O. Из предложенного перечня выберите вещества Х и Y, которые могут вступать в описанные реакции.
1) Na
2) Na2O
3) NaOH
4) NaCl
5) Na2CO3
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
- Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) Al | 1) CuO, HNO3(p-p), CsOH (p-p) |
| Б) O2 | 2) Cu, HNO3, H2 |
| В) S | 3) HBr, Cu, CO |
| Г) K | 4) CH3OH, H2O, Br2 |
| 5) CaCl2, NaOH, HCl |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) Cr + Cl2 | 1) CrCl2 |
| Б) Cr + HCl | 2) CrCl3 |
| В) CrO + HCl | 3) CrCl2 + H2 |
| Г) Cr2O3 + HCl | 4) CrCl3 + H2 |
| 5) CrCl2 + H2O | |
| 6) CrCl3 + H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) Cl2
2) HCl
3) KHS
4) KHCO3
5) KOH
Запишите в таблицу номера веществ под соответствующими буквами.
- Установите соответствие между формулой вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
| А) C2H5 – O – C3H7 | 1) углеводы
2) углеводороды 3) простые эфиры 4) сложные эфиры |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите две пары веществ, которые при взаимодействии с избытком водорода образуют гомологи.
1) бутин-1 и пентадиен-1,3
2) бутадиен-1,3 и бутин-2
3) 2-метилпропен и бутадиен-1,3
4) гексен-3 и 4-метилпентин-1
5) ацетилен и пропилен
Запишите в поле ответа номера выбранных пар веществ.
- Из предложенного перечня выберите два способа получения этина в лаборатории.
1) нагревание этанола в присутствии концентрированной серной кислоты при температуре выше 170С
2) добавление спиртового раствора щёлочи к хлорэтану
3) гидролиз карбида кальция
4) добавление воды к ацетилену в присутствии солей ртути
5) добавление спиртового раствора щёлочи к 1,2-дихлорэтану
Запишите в поле ответов номера выбранных способов.
- Из предложенного перечня выберите два класса/группы веществ, с которыми НЕ реагирует фенол.
1) щёлочи
2) разбавленные кислоты
3) активные металлы
4) бромная вода
5) алканы
Запишите в поле ответа номера выбранных классов/групп веществ.
- Из предложенного перечня выберите два вещества, которые образуются при взаимодействии хлорангидрида уксусной кислоты и метиламина при нагревании.
1) CH3COONH4
2) CH3COONHCH3
3) CH3C(O)NHCH3
4) HCl
5) CH3Cl
Запишите в поле ответа номера выбранных веществ.
- Установите соответствие между схемой реакции и реагентом Х, который учаcтвует в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | РЕАГЕНТ Х |
| А) CH3–СН(CH3)–CH3 + X → CH3–СCl(CH3)–CH3 | 1) HCl |
| Б) HC≡C-CH3 + X → CuC≡C-CH3 | 2) Na |
| В) H2C=CH-CH3 + X → CH3-CHCl-CH3 | 3) Cl2 |
| Г) CH3-CH(CH3)-COONa + X → CH3-CH2-CH3 | 4) NaOH |
| 5) Cu | |
| 6) CuCl (p-p NH3) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между химическим процессом и органическим веществом, которое является продуктом этого процесса: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ХИМИЧЕСКИЙ ПРОЦЕСС | ПРОДУКТ ПРОЦЕССА |
| А) окисление пропаналя | 1) пропановая кислота |
| Б) щелочной гидролиз 1,1,1-трихлорпропана | 2) глицерин |
| В) восстановление пропионового альдегида | 3) пропанол-1 |
| Г) щелочной гидролиз пропилпропаноата | 4) пропанол-2 |
| 5) пропанон | |
| 6) пропаналь |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) водород
2) вода
3) метановая кислота
4) бутановая кислота
5) бутанол-1
Запишите в таблицу номера веществ под соответствующими буквами.
- Из предложенного перечня типов реакций выберите два типа реакций, к которым можно отнести взаимодействие медной проволоки с серой.
1) гомогенная
2) гетерогенная
3) каталитическая
4) необратимая
5) обмена
Запишите в поле ответа номера выбранных типов реакций.
- Из предложенного перечня выберите два внешних воздействия, которые приводят к уменьшению скорости реакции щелочного гидролиза моногалогеналканов.
1) повышения температуры
2) уменьшение концентрации щёлочи
3) добавление разбавленной серной кислоты
4) повышение давления
5) увеличение концентрации исходных веществ
Запишите в поле ответа номера выбранных внешних воздействий.
- Установите соответствие между схемой превращения и изменением степени окисления магния в этих превращениях: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Установите соответствие между формулой соли и схемой электролиза этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | СХЕМА ЭЛЕКТРОЛИЗА |
| А) K2SO4 (расплав) | 1) H2O → H2 + O2 |
| Б) Cu(NO3)2 (раствор) | 2) K2SO4 → K + SO3 + O2 |
| В) CH3COOK (раствор) | 3) H2O + CH3COOK → KOH + H2 + C2H6 + CO2 |
| Г) Na2SO4 (раствор) | 4) H2O + CH3COOK → KOH + H2 + C4H10 + CO2 |
| 5) Na2SO4 → Na + SO3 + O2 | |
| 6) Cu(NO3)2 + H2O → Cu + O2 + HNO3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названием соли, и концентрациями ионов водорода и гидроксид-ионов в растворе этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | КОНЦЕНТРАЦИИ H+ и ОН— |
| А) сульфат натрия | 1) H+ > ОН— |
| Б) хлорид цинка | 2) H+ < ОН— |
| В) фторид олова (II) | 3) H+ = ОН— (или приблизительно равно) |
| Г) фосфат калия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между внешним воздействием и направлением изменения количества молекул метиламина в водном растворе, в котором установилось равновесие CH3NH2 + H2O ↔ CH3NH3+ + OH— : к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВНЕШНЕЕ ВОЗДЕЙСТВИЕ | НАПРАВЛЕНИЕ ИЗМЕНЕНИЯ КОЛИЧЕСТВА МОЛЕКУЛ МЕТИЛАМИНА |
| А) добавление избытка воды | 1) уменьшается |
| Б) добавление небольшого количества твёрдой щёлочи | 2) увеличивается |
| В) добавление небольшого количества твёрдого хлорида метиламмония | 3) практически не смещается |
| Г) пропускание через раствор небольшого количества сероводорода |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между веществом, взятым в виде водного раствора, и реактивом, с помощью которого можно качественно обнаружить это вещество: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | РЕАКТИВ |
| А) KHCO3 | 1) KOH |
| Б) K2SO4 | 2) BaCl2 |
| В) CuCl2 | 3) Cu |
| Г) HNO3 (разб.) | 4) HCl |
| 5) CuS |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между утверждением и его правильностью: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УТВЕРЖДЕНИЕ | ПРАВИЛЬНОСТЬ |
| А) в лаборатории нельзя пробовать вещества на вкус | 1) верно |
| Б) в лаборатории можно высыпать просыпанное вещество обратно в банку с исходным реактивом | 2) не верно |
| В) при разбавлении концентрированных кислот небольшими порциями следует приливать кислоту в воду, а не наоборот | 3) частично верно |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Рассчитайте массу раствора гидроксида натрия (в граммах) с массовой долей 40%, который следует взять для приготовления раствора массой 200 г с массовой долей щёлочи, равной 15%. (Запишите число с точностью до целых.)
- Какой объём водорода потребуется для полного гидрирования 1,2 л дивинила? Объёмы газов измерены в одинаковых условиях. (Запишите число с точностью до десятых.)
- Вычислите массу оксида марганца (IV) (в граммах), которую нужно прокалить для получения 8 г кислорода, если в результате прокаливания образуется кислород и смешанный оксид марганца (II, III). (Запишите число с точностью до десятых.)
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
сернистый газ, гидроксохлорид меди (II), хлорид натрия, перманганат калия, гидросульфат калия, гидроксид калия. Допустимо использование водных растворов веществ.
- Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора и образованием осадка. Выделение газа в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
- Из предложенного перечня веществ выберите основную соль и вещество, которое вступает с этой основной солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
- При пропускании сероводорода через раствор сульфата меди (II) получен осадок, который отделили фильтрованием и высышили. Образовавшийся осадок добавили к концентрированному раствору азотной кислоты. Выделившийся в результате этого бурый газ собралии и пропустили над нагретым фосфором, в результате чего образовалось твёрдое вещество и газ, входящий в состав воздуха. Далее к этому твёрдому веществу по каплям добавляли хлорную кислоту, в результате чего получили кислоту и ангидрид кислоты. Напишите уравнения четырёх описанных реакций.
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
- Через 264,475 г насыщенного раствора сульфата натрия некоторое время пропускали электрический ток. В результате чего образовалось 248,506 л газов и часть соли выпало в осадок в виде кристаллогидрата Na2SO4∙10H2O.Определите массу (в г) образовавшегося осадка. Растворимость безводного сульфата натрия при данных условиях составляет 19,2 г на 100 г воды. Температура при проведении электролиза не менялась и все измерения проводились при одинаковых условиях. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических венличин).
- При сгорании 40,5 г неизвестного органического вещества получили 40,32 л углекислого газа (н.у.) и 40,5 г воды. Из навески этого вещества массой 20,25 г вся сера была переведена в сульфат-ион, который дал осадок BaSO4 массой 52,425 г. Неизвестное органическое вещесто относится к классу тиоэфиров, которые по строению схожи с простыми эфирами, только вместо атомов кислорода содержат атомы серы. Известно, что это вещество имеет симметричное строение и может быть получено по реакции моногалогеналкана с сульфидом натрия при нагревании.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение получения этого органического вещества из моногалогеналкана и сульфида натрия (используйте структурные формулы органических веществ).
Система оценивания экзаменационной работы по химии
Часть 1
За правильный ответ на каждое из заданий 1–6, 11–15, 19–21, 26–29 ставится 1 балл.
Задание считается выполненным верно, если экзаменуемый дал правильный ответ в виде последовательности цифр или числа с заданной степенью точности.
Задания 7–10, 16–18, 22–25 считаются выполненными верно, если правильно указана последовательность цифр.
За полный правильный ответ заданий 7–10, 16–18, 22–25 ставится 2 балла; если допущена одна ошибка – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
| Номер задания | Правильный ответ |
| 1 | 14 |
| 2 | 431 |
| 3 | 25 |
| 4 | 45 |
| 5 | 234 |
| 6 | 23 |
| 7 | 23 |
| 8 | 1324 |
| 9 | 2356 |
| 10 | 25 |
| 11 | 341 |
| 12 | 15 |
| 13 | 35 |
| 14 | 25 |
| 15 | 34 |
| 16 | 3614 |
| 17 | 1133 |
| 18 | 14 |
| 19 | 24 |
| 20 | 23 |
| 21 | 434 |
| 22 | 2631 |
| 23 | 3132 |
| 24 | 1221 |
| 25 | 4213 |
| 26 | 121 |
| 27 | 75 |
| 28 | 2,4 |
| 29 | 65,3 |
Часть 2
Критерии оценивания заданий с развёрнутым ответом
За выполнение заданий 30, 31 ставится от 0 до 2 баллов; задания 35 – от 0 до 3 баллов; заданий 32 и 34 – от 0 до 4 баллов; задания 33 – от 0 до 5 баллов.
Задание 30
Вариант ответа:
2KMnO4 + 3SO2 + 4KOH → 3K2SO4 + 2MnO2↓ + 2H2O
2 Mn+7 + 3ē → Mn+4
3 S+4 – 2ē → S+6
Сернистый газ или сера в степени окисления +4 является восстановителем.
Перманганат калия или марганец в степени окисления +7 – окислителем
Задание 31
Вариант ответа:
CuOHCl + KOH = Cu(OH)2 + KCl
CuOH+ + Cl— + K+ + OH— = Cu(OH)2 + K+ + Cl—
CuOH+ + OH— = Cu(OH)2
Задание 32
Вариант ответа:
CuSO4 + H2S = CuS + H2SO4
CuS + 8HNO3 (конц) = CuSO4 + 8NO2 + 4H2O
10NO2 + 8P = 4P2O5 + 5N2
2HClO4 + P2O5 = Cl2O7 + 2HPO3
Задание 33
Примечание. Допустимо использование структурных формул разного вида (развёрнутой, сокращённой, скелетной), однозначно отражающих порядок связи атомов и взаимное расположение заместителей и функциональных групп в молекуле органического вещества.
Задание 34
Объяснение этой задачи вы можете найти на Ютуб по ссылке
Ответ: 76,6 г
Задание 35
Исходное органическое вещество точно содержит в своём составе углерод, водород и серу, так как при сгорании этого вещества образуются углекислый газ и вода, и серу выделяют через осадок сульфида бария. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода, водорода и серы, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода,водорода и серы и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M, n = V/Vm.
n (CO2) = 40,32 л/22,4 л/моль = 1,8 моль
n (С) = n (СО2) = 1,8 моль
m (C) = 1,8 моль ∙ 12 г/моль = 21,6 г
n (H2O) = 40,5 г / 18 г/моль = 2,25 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 2,25 моль = 4,5 моль
m (H) = 4,5 моль ∙ 1 г/моль = 4,5 г
Надо заметить, что при сжигании, масса вещества была 40,5 г, а при выделении серы – 20,25 г. Поэтому надо привести эти массы к одному значению. Эти массы отличаются в 2 раза, значит при из 40,5 г вещества можно выделить в 2 раза больше осадка сульфата бария: 2 ∙ 52,425 = 104,85 г.
n (BaSO4) = 104,85 г/233 г/моль = 0,45 моль
n (S) = n (BsSО4) = 0,45 моль
m (S) = 0,45 моль ∙ 32 г/моль = 14,4 г
m (C) + m (H) + m (S) = 21,6 г + 4,5 г + 14,4 г = 40,5 г, что равно массе исходного вещества, а значит там НЕТ кислорода.
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (S) = 1,8 : 4,5 : 0,45 = 4 : 10 : 1
Следовательно молекулярная формула вещества: C4H10S.
Так как вещество имеет симметричное строение, то структурная формула:
CH3 – CH2 – S – CH2 – CH3
Уравнение получения по реакции моногалогеналкана с сульфидом натрия при нагревании:
2CH3 – CH2 – Cl + Na2S → CH3 – CH2 – S – CH2 – CH3 + 2NaCl
Также вы можете скачать:
- Пробный вариант №1 ЕГЭ 2020 г. (аналог демонстрационного варианта ЕГЭ 2020 г.) с ответами в формате pdf
- Пробный вариант 2. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 3. ЕГЭ 2020 по химии с ответами в формате pdf
- Демонстрационный вариант ЕГЭ 2020 (с сайта ФИПИ)
- Кодификатор ЕГЭ 2020 (с сайта ФИПИ)
- Спецификация ЕГЭ 2020 (с сайта ФИПИ)
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку



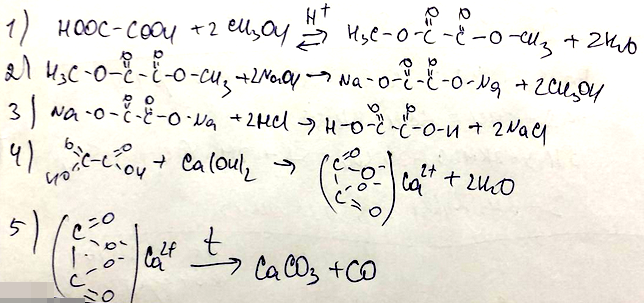
Такие типы заданий 35 действительно могут попасться на ЕГЭ?
Здравствуйте. В 2020 году, как уверяют составители, будет только 2 типа задач 35: на массовые доли элементов в соединении и на продукты сгорания
Здравствуйте, а в 30 задании нет случайно ошибки? Перманганат калия в щелочной среде превращается в манганат, а в реакции оксид марганца 4
Заранее спасибо
Здравствуйте. Вопрос по делу! Это интересная реакция, так как здесь можно написать как манганат калия, так и оксид марганца (IV). Вы правы, что в щелочной среде перманганат переходит в манганат. Но на эту реакцию можно посмотреть с другой стороны: сернистый газ в растворе проявляет кислотные свойства, а следовательно он нейтрализует щелочную реакцию среды и среда стремится к нейтральной, что позволяет образоваться оксиду марганца (IV). Поэтому в этом задании надо было ориентироваться на признаки реакции приведённые в условии.
Здравствуйте! В 32 задании в четвертой реакции будет разве не фосфорная кислота?
Заранее спасибо
В этой реакции также можно написать 2 варианта: либо метафосфорную кислоту (HPO3) либо орто фосфорную (H3PO4), так как степень окисления фосфора в них одинакова и равна +5. Но в условии задания сказано, что кислоту добавляли по каплям, а это значит, что она в недостатке, а следовательно будет «недостаточно» атомов водорода для образования ортофосфорной кислоты (H3PO4), поэтому лкчше всего писать метафосфорную кислоту