Задачи ЕГЭ по химии 2021
Предлагаем вашему вниманию задачи с подробными видео-объяснениями из реального ЕГЭ 2021 (основная волна 31 мая 2021 года), а также видео-разбор задач из демо ЕГЭ 2021 и досрочного ЕГЭ 2021. А ещё видео-разбор пробных (тренеровочных) вариантов ЕГЭ 2021.
Задания 34 представлены в начале статьи, а задания 35 — во второй половине (листайте ниже), а задания демо ЕГЭ 2021, досрочного ЕГЭ 2021 и пробных вариантов — в конце статьи (листайте ниже).
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
ВНИМАНИЕ — в ЕГЭ 2022 года это будут задание 33 и 34 вместо 34 и 35 соответственно
В этом году в разных регионах были задачи, включающие разные типы решения. В основном это были задачи на растворы (массовую долю) плюс:
- 1. Электролиз + система уравнений
- 2. Электролиз + кристаллогидраты + растворимость
- 3. Задачи на атомистику + вывод формул + электролиз + кристаллогидраты
- 4. На соотношение атомов (атомистика) + система уравнений + кислые/средние соли
- 5. На разделение раствора на несколько колб (частей).
Задачи на электролиз + система уравнений
1. Через 520 г 16,1%-ного раствора сульфата цинка пропускали электрический ток до тех пор, пока объем газа, выделившегося на катоде, не стал равен объему газа, выделившемуся на аноде. При этом массовая доля сульфата цинка понизилась до 10,3%. К полученному раствору добавили 212 г 10% раствора карбоната натрия. Вычислите массовую долю сульфата цинка в полученном растворе.
Решение: смотри видео
2. Через 400 г 36%-ного раствора нитрата железа (II) пропустили электрический ток до момента, когда объём газа, выделившегося на катоде, не стал в 2 раза меньше объёма газа, выделившегося на аноде. В полученном растворе массовая доля нитрата железа (II) уменьшилась до 10,19%. К полученному раствору прилили 120 г 40%-ного раствора карбоната аммония. Определите массовую долю нитрата железа (II) в конечном растворе. (Окислением ионов железа 2+ и их осаждением в прикатодном пространстве пренебречь.)
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
Задачи на электролиз + кристаллогидраты + растворимость
3. Электролиз 5%-ного раствора нитрата бария массой 522 г проводили до тех пор, пока на аноде не выделилось 8,4 л газа. К образовавшему раствору прилили насыщенный раствор, полученный при растворении 96,6 г глауберовой соли (Na2SO4∙10H2O) в воде. В результате массовая доля сульфата натрия уменьшилась в 4,5 раза. Определите растворимость безводного сульфата натрия на 100г воды.
Решение: смотри видео
4. Электролиз 10%-ного раствора нитрата бария массой 522 г проводили до тех пор, пока 4,2 моля воды не ушли. К образовавшему раствору прилили насыщенный раствор, полученный при растворении 100 г медного купороса (CuSO4∙5H2O) в воде. В результате массовая доля сульфата меди (II) уменьшилась в 4 раза. Определите растворимость безводного сульфата меди (II) на 100г воды.
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
Задачи на атомистику + вывод формул + электролиз + кристаллогидраты
5. Кристаллогидрат сульфата алюминия, в котором массовая доля серы в 5 раз меньше массовой доли кислорода, растворили в воде. При этом образовался раствор массой 722,4 г. Через полученный раствор пропускали электрический ток до тех пор, пока на аноде не выделилось 35,84 л газа. Затем к образовавшемуся растврору прилили раствор карбоната натрия массой 424 г с массовой долей соли 10%. При этом массовая доля карбоната натрия уменьшилась в 10 раз. Вычислите массу растворенного кристаллогидрата.
Задачи на атомистику (на соотношение атомов) + система уравнений + кислые/средние соли
6. Смесь оксида фосфора (V) и оксида калия, в которой соотношение числа атомов кислорода к числу атомов фосфора равно 14,5 : 4, сплавили, а затем образовавшуюся смесь растворили в воде. В результате получили 447,4г раствора, в котором массовая доля атомов водорода равна 7,6%. Определите массу фосфата калия в полученном растворе.
Решение: смотри видео
7. Смесь оксида натрия и оксида фосфора (V), в которой соотношение числа атомов фосфора к числу атомов натрия равно 7 : 18, нагрели и растворили в горячей воде. В результате получили 312,5 г раствора, в котором массовая доля атомов водорода равна 7,36%. Определите массу фосфата натрия в полученном растворе.
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
Задачи на разделение раствора на несколько колб (частей):
8. Смесь, состоящую из нитрата цинка, нитрата меди (II) и нитрата серебра, растворили в воде. При этом получили раствор, в котором массовая доля нитрата цинка составила 18,9%, а массовая доля нитрата меди (II) – 9,4%. В первую колбу налили 500 г этого раствора и внесли медную проволоку. После окончания реакции массовая доля нитрата меди (II) в колбе составила 25,5%. (Возможной реакцией избытка меди с нитратом меди (II) пренебречь.) Во вторую колбу налили 200 г исходного раствора и добавили избыток порошка цинка. Вычислите массовую долю соли в конечном растворе во второй колбе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Решение: смотри видео
9. Раствор нитрата меди (II) массой 1760 г с массовой долей нитрата меди (II) 18,8%, содержащий в качестве примеси нитрат серебра (I) разлит на 2 колбы в соотношении 1:2. В первую колбу, содержащую меньшую часть раствора, опустили медную проволку. После завершения реакции проволку извлекли из раствора. При этом массовая доля нитрата меди(II) в первой колбе составила 20%. (Возможной реакцией избытка меди с нитратом меди (II) пренебречь.) В раствор во второй колбе внесли избыток порошок цинка, в результате получили бесцветный раствор. Вычислите массовую долю соли в конечном растворе во второй колбе.
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
10. Смесь бромида кальция и хлорида меди (II) растворили в воде, а образовавшийся раствор разделили на 3 колбы. В первую колбу, содержащую 200 г раствора, добавили 785 г 30% раствора нитрата серебра (I), в результате чего массовая доля нитрата серебра (I) уменьшилась вдвое. Во вторую колбу, содержащую 340 г исходного раствора солей, добавили избыток йодида калия, при этом в осадок выпала соль массой 64,94 г. Определите массовые доли солей в третьей колбе.
Решение: смотри видео
11. Смесь бромида калия и йодида калия растворили в воде. Образовавшийся раствор разделили на 3 колбы. В первую колбу с раствором массой 250 г прилили раствор массой 430 г 40%-ного нитрата серебра (I). После реакции массовая доля нитрата серебра (I) в растворе уменьшилась до 8,44%. Во вторую колбу с раствором массой 300 г прилили избыток раствора нитрата меди (II), в результате чего выпало 28,65 г осадка. Найдите массовые доли солей в третьей колбе колбе.
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
12. Смесь гидроксида и хлорида бария растворили в воде. Раствор разлили на три колбы. В первую колбу, масса раствора в которой равна 520 г, добавили избыток серной кислоты, при этом выпало 163,1 г осадка. К 130 г раствора во второй колбе добавили 166,5 г 20% раствора соляной кислоты, при этом массовая доля кислоты уменьшилась в 2 раза. Найдите массовые доли веществ в третьей колбе.
Решение: смотри видео
13. Смесь хлоридов бария и алюминия растворили в воде. Полученный раствор разделили на 3 колбы. К 300 г раствора в первой колбе прилили 164 г 10% раствора фосфата натрия, в результате чего все исходные вещества прореагировали полностью. К 120 г раствора второй колбы добавили 155,61 г 20 % раствора сульфата натрия, при этом массовая доля сульфата натрия в конечном растворе оказалась в 2 раза меньше, чем в исходном. Определите массовые доли веществ в третьей колбе. Гидролизом солей пренебречь.
Решение: смотри видео
14. Хлорид алюминия и хлорид магния смешали и растворили в воде. Образовавшийся раствор разделили на 3 колбы. В первую колбу с раствором массой 300 г добавили 164 г 10%-ного раствора фосфата натрия. Причём соль прореагировала полностью. Во вторую колбу с раствором массой 120 г прилили 155,64 г 20%-ного раствора сульфата натрия. Причём массовая доля сульфата натрия в исходном растворе была в два раза больше, чем массовая доля в конечном растворе. Определите массовые доли солей в третьей колбе. Гидролизом пренебречь.
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
15. Смесь сульфата железа (II) и хлорида цинка растворили в воде. Полученный раствор разделили на 3 колбы. К 800 г раствора в первой колбе прилили избыток раствора нитрата бария, при этом выпал осадок массой 116,5 г. К 320 г раствора второй колбы добавили 462 г 40 %-ного раствора гидроксида натрия без доступа воздуха, при этом массовая доля щёлочи уменьшилась в два раза. Определите массовые доли веществ в третьей колбе. Гидролизом солей пренебречь.
Решение: смотри видео
16. Смесь нитрата алюминия и хлорида магния растворили в воде. Образовавшийся раствор разделили на 3 колбы. В первую колбу с раствором массой 750 г добавили раствор нитрата серебра (I), в результате чего выпал осадок массой 114,8 г. Во вторую колбу с раствором массой 300 г прилили 868,54 г 20%-ного раствора гидроксида натрия. Причём массовая доля щёлочи уменьшилась в 1,6 раз. Определите массовые доли солей в третьей колбе. Гидролизом пренебречь.
Решение:
(АНАЛОГИЧНАЯ ПРЕДЫДУЩЕЙ. Если у вас не получается её решить, то смотрите предыдущее видео и решайте по анологии)
Демо ЕГЭ 2021
Демо ЕГЭ по химии 2021. Задание 34. (Аналогично демо ЕГЭ 2020)
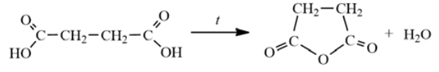
При нагревании образца карбоната магния часть вещества разложилась. При этом выделилось 29,12 л (н.у.) углекислого газа. Масса твёрдого остатка составила 136 г. Этот остаток добавили к 763.6 г раствора бромоводородной кислоты, с массовой долей 53,04%. Определите массовую долю кислоты в полученном растворе, если растворимость соли, содержащейся в этом растворе, при данных условиях составляет 101,1 г га 100 г воды. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических венличин).
Демо ЕГЭ по химии 2021. Задание 35. (Аналогично демо ЕГЭ 2020)
При сгорании 26,2 г органического вещества получили 26,88 л углекислого газа (н.у.), 2,24 л азота (н.у.) и 23,4 г воды. При нагревании с бромоводородной кислотой данное вещество подвергается гидролизу, продуктами которого являются соединение состава C2H6NO2Br и третичный спирт.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение гидролиза вещества в присутствии бромоводородной кислоты (используйте структурные формулы органических веществ).
Досрочный ЕГЭ 2021
Задание 34. Открытый вариант ФИПИ. (Досрочная волна 2021)
Нитрат кальция медленно нагрели, при этом образовался твёрдый осадок, состоящий из смеси оксида кальция и нитрита кальция, и выделилась смесь газов. Смесь газов пропустили через 133,6 г 40%-ного раствора гидроксида калия. При этом массовая доля гидроксида калия в растворе уменьшилась в 2 раза, а объём непрореагировавшего газа оказался в 2 раза меньше объёма исходной смеси газов. Вычислите массу исходного нитрата кальция.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Задание 35. Открытый вариант ФИПИ. (Досрочная волна 2021)
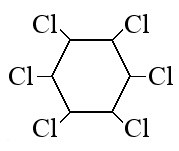
При сгорании органического вещества А массой 43,65 г получили 20,16 л (н.у.) углекислого газа и 20,16 л (н.у.) хлороводорода.
Вещество А образуется при взаимодействии вещества Б с хлором под действием ультрафиолетового освещения. Известно, что в молекуле вещества Б все атомы углерода находятся в sp2-гибридизации, а в молекуле вещества Б — в sp3-гибридизации. На основании данных задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А при хлорировании вещества Б (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть- 1. n = m/M, n = V/Vm
m = n ∙ M,
n (CO2) = 20,16 л / 22,4 л/моль = 0,9 моль
n (С) = n (СО2) = 0,9 моль
m (C) = 0,9 моль ∙ 12 г/моль = 10,8 г
n (HCl) = 20,16 л / 22,4 л/моль = 0,9 моль
n (H) = n (HCl) = 0,9 моль
m (H) = 0,9 моль ∙ 1 г/моль = 0,9 г
m (Cl) = 0,9 моль ∙ 35,5 г/моль = 31,95 г
m (C) + m (H) + m (Cl) = 10,8 г + 0,9 г + 31,95 г = 43,65 г
m (O) = 43,65 г – 43,65 г = 0
n (C) : n (H) : n (Cl) = 0,9 : 0,9 : 0,9 = 1 : 1 : 1 = 6 : 6 : 6
Следовательно молекулярная формула C6H6Cl6
Пробные (тренировочные) варианты 2021
Задание 34. Пробный вариант 1
В 120 мл раствора с плотностью 0,591 г/мл, содержащего нитрат свинца (II) и нитрат меди (II) с массовыми долями 16,34 и 2,65% соответственно, насыпали 5,6 г железных опилок. Через некоторое время раствор отфильтровали. Масса твёрдых веществ составила 8,7 г. Определите соотношение числа ионов металлов в конечном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Задание 34. Пробный вариант 2
К 500 мл раствора гидроксида бария с плотностью 1,02 г/мл постепенно при перемешивании добавляли раствор гидрокарбоната натрия с массовой долей соли 5%. К тому моменту, когда соотношение числа ионов натрия и гидроксид-ионов в растворе стало равно 1:1, масса раствора стала равной 658,3 г. Определите массовые доли веществ в растворе, который получится при медленном добавлении 100 мл такого же исходного раствора гидроксида бария к раствору гидрокарбоната натрия, масса которого в два раза меньше, а массовая доля соли такая же, как и в первом эксперименте.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Задание 34. Пробный вариант 3
141,5 г смеси фосфата калия и оксида фосфора (V), в которой массовая доля фосфора как элемента составляет 21,91%, растворили в 400 г воды. Определите массовые доли веществ в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Задание 34. Пробный вариант 4
К 200 г раствора нитрата алюминия с массовой долей соли 12,78% добавили 123,9 мл раствора гидроксида натрия с массовой долей щёлочи 0,12 и плотностью 1,13 г/мл. Полученную смесь упарили и прокалили до постоянной массы. Определите массовую долю кислорода как элемента в твёрдом остатке после прокаливания.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Задание 34. Пробный вариант 5
В два последовательно соединённых электролизёра поместили по 100 г растворов: в первый 10% (по массе) раствор хлорида натрия, во второй – 20% (по массе) хлорида золота (III) и включили ток. Через некоторое время электролиз прекратили и масса раствора в первом электролизёре уменьшилась на 3,285 г. Определите массовую долю хлорида золота (III) во втором электролизёре после электролиза. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Задание 34. Пробный вариант 6
В раствор хлороводорода массой 165 г, в котором N(H)/N(O) = 2,123, поместили 10 г железной окалины. После полного окончания реакции в образовавшийся раствор погрузили избыток металлического железа. Рассчитайте массовую долю (%) соли в конечном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Задание 34. Пробный вариант 7
Смесь оксида железа (II), оксида железа (III) и оксида железа (II, III) общей массой 161 г полностью восстановили углеродом. При этом образовалось только железо и углекислый газ объёмом 39,2 л. Образовавшийся порошок железа засыпали в раствор хлорида меди (II) массой 1200 г с массовой долей соли 25% и оставили на несколько дней. Рассчитайте массовую долю (%) хлорида меди (II) в конечном растворе, считая, что железо прореагировало полностью, а в исходной смеси оксидов железа могли содержаться примеси оксидов железа нестехиометрического состава.
Задание 34. Пробный вариант 8
В закрытом сейфе рядом находятся два открытых стаканчика. В одном из них находится насыщенный раствор сульфата железа (II) массой 425 г, во втором – твёрдый сульфат кальция массой 27,2 г. В результате длительного хранения этих реактивов, сульфат кальция превратился в гипс (считать, что в воздухе сейфа паров воды не содержалось), а в первом стаканчике выпал осадок кристаллогидрата FeSO4∙7H2O. Рассчитайте массу выпавшего в осадок кристаллогидрата, если массовая доля FeSO4 в насыщенном растворе при данных условиях равна 14,6%.
Задание 34. Пробный вариант 9
Имеется смесь оксида кобальта (II), оксида кобальта (III) и оксида кобальта (II, III), содержащая примеси оксидов кобольта нестехиометрического состава. Эту смесь массой 0,782 г полностью восстановили водородом, в результате чего было получено твёрдое вещество массой 0,590 г. Эту же смесь массой 1,564 г полностью растворили в растворе бромоводородной кислоты массой 48,6 г с массовой долей растворённого вещества 10%. Рассчитайте максимальную массу кобальта, которую можно ещё растворить в полученном растворе, чтобы в нём содержалась только одна соль.
Задание 34. Пробный вариант 10
Горная порода, содержащая силикат кальция при взаимодействии с дождевой водой и углекислым газом из воздуха образует кварцевый песок и гидрокарбонат кальция. Рассчитайте объём (н.у., м3) углекислого газа, который вступил в реакцию с исходной горной породой массой 100 кг (массовая доля силиката 80%, примеси в воде не растворимы), если в результате реакции массовая доля CaSiO3 в твёрдом остатке составила 50%.
Задание 35. Пробный вариант 1
Неизвестное органическое вещество А содержит 34,62% углерода, а также водород и кислород, причём массовая доля кислорода в 15,982 раза больше массовой доли водорода. Известно, что 1 моль вещества А может вступить в реакцию с 2 моль гидроксида натрия, или 1 моль гидрокарбоната калия, или 1 моль метанола.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции вещества А с избытком метанола (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть1. Общая формула вещества CxHyOz
ω (O + H) = 100% — 34,62% = 65,38%
Пусть ω (Н) = х %, тогда ω (О) = 15,982х %, следовательно получаем математическое уравнение:
х + 15,982х = 65,38
16,982х = 65,38
х = 3,85% (ω (Н)), ω (О) = 15,982∙3,67 = 61,53%
x : y : z = 34,62/12 : 3,85/1 : 61,53/16 = 2,885 : 3,85 : 3,85 = 3 : 4 : 4
Следовательно, молекулярная формула C3H4O4.
- По описанным данным, можно предположить, что раз это вещество реагирует только с 1 моль гидрокарбоната или 1 моль спирта, то значить в этом веществе находится одна карбоксильная группа, но так как это же вещество может реагировать с 2 моль щелочи, то значит есть эфирная связь, которая будет подвергаться щелочному гидролизу. Поэтому это монометиловый эфир щавелевой кислоты.
Задание 35. Пробный вариант 2
При сгораниии 9,9 г органического вещества А получили 12,096 л углекислого газа, 0,672 л азота (н.у.) и 5,94 г воды.
Известно, что вещество А подвергается и щелочному и кислотному гидролизу, при этом образуется первичный насыщенный одноатомный спирт (молекула которого содержит 2 атома углерода) и органическая соль (соль образуется при любом типе гидролиза). Также известно, что вещество А можно получить каталитическим гидрированием вещества Б, в котором заместители максимально удалены друг от друга.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А путём каталитического гидрирования вещества Б (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть1) исходное органическое вещество точно содержит в своём составе атомы элементов углерод, азот и водород, так как при сгорании этого вещества образуются углекислый газ, газ азот и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода, азота и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода, азота и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, n = V/Vm
m = n ∙ M,
n (CO2) = 12,096 л / 22,4 л/моль = 0,54 моль
n (С) = n (СО2) = 0,54 моль
m (C) = 0,54 моль ∙ 12 г/моль = 6,48 г
М(Н2О) = 18 г/моль
n (H2O) = 5,94 г / 18 г/моль = 0,33 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,33 моль = 0,66 моль
m (H) = 0,66 моль ∙ 1 г/моль = 0,66 г
n (N2) = 0,672 л / 22,4 л/моль = 0,03 моль
n (N) = 2 ∙ n (N2) = 2 ∙ 0,03 моль = 0,06 моль
m (N) = 0,06 моль ∙ 14 г/моль = 0,84 г
m (C) + m (H) + m (N) = 6,48 г + 0,66 г + 0,84 г = 7,98 г, что НЕ равно массе исходного вещества, а значит атомы кислорода присутствуют в веществе.
m (O) = 9,9 г – 7,48 г = 1,92 г
n (O) = 1,92 г / 16 г/моль = 0,12 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (N) : n (O) = 0,54 : 0,66 : 0,06 : 0,12 = 9 : 11 : 1 : 2
Следовательно молекулярная формула вещества: C9H11NO2.
2) Анализируя информацию о веществе А, можно предположить, что гидролизу подвергаются такие классы органических веществ, как эфиры (включая жиры), углеводы, пептиды, ангидриды кислот и некоторые другие. Но с образованием спирта гидролизуются только эфиры. Причём если молекула спирта содержит только два атома углерода, то делаем вывод, что вещество А – это сложный эфир некой кислоты и спирта этанола. Необходимо заметить, что в независимости от тиипа гидролиза образуется соль, а такое возможно для аминокислот. Следовательно мы имеем сложный эфир, состоящий из остатков спирта этанола и некой аминокислоты, причем ароматической, так как молекулярная формула содержит малое количество атомов водорода. Используя информацию о получении вещества А гидрированием вещества Б, делаем вывод, что вещество Б –нитросоединение, содержащее NO2-группу, потому что при гидрировании нитро-группа переходит в амино-группу (NH2-). А также понимаем, что эта нитро-группа находится в пара-положении, так как только это положение подходит под описание, когда заместители максимально удалены друг от друга, там же будет и NH2-группа.
Следовательно, структурная формула — 
3) Уравнение получения вещества А путём гидрирования вещества Б:
Задание 35. Пробный вариант 3
При сгорании 13,28 г органического вещества А получили 3,8528∙1023 молекул углекислого газа и 4,32 мл воды.
Известно, что вещество А содержит атомы углерода только в sp2-гибридизации, заместители максимально удалены друг от друга, а также может вступать в реакцию с метанолом (в присутствии серной кислоты) в соотношении либо 1:1 либо 1:2.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции взаимодействия вещества А с метанолом (в присутствии серной кислоты) в соотношении 1:2 соответственно (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть1) исходное органическое вещество точно содержит в своём составе атомы элементов углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = N/NA, n = m/M
m = n ∙ M,
n (CO2) = 3,8528 молекул / 6,02∙1023 моль-1 = 0,64 моль
n (С) = n (СО2) = 0,64 моль
m (C) = 0,64 моль ∙ 12 г/моль = 7,68 г
т.к. плотность воды 1 г/мл, то m (H2O) = 4,32 мл ∙ 1 г/мл = 4,32 г
М(Н2О) = 18 г/моль
n (H2O) = 4,32 г / 18 г/моль = 0,24 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,24 моль = 0,48 моль
m (H) = 0,48 моль ∙ 1 г/моль = 0,48 г
m (C) + m (H) = 7,68 г + 0,48 г = 8,16 г, что НЕ равно массе исходного вещества, а значит атомы кислорода присутствуют в веществе.
m (O) = 13,28 г – 8,16 г = 5,12 г
n (O) = 5,12 г / 16 г/моль = 0,32 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 0,64 : 0,48 : 0,32 = 2 : 1,5 : 1 = 4 : 3 : 2. Но составить структурную формулу с таким соотношением атомов не представляется возможным, поэтому данные индексы надо ещё раз удвоить.
Следовательно молекулярная формула вещества: C8H6O4.
2) Анализируя информацию о веществе А, можно предположить, что данное вещество является ароматическим, так как молекула содержит небольшое число атомов водорода. И так как реагирует со спиртами, то это может быть карбоновая кислота, но с учётом разного соотношения – дикарбоновая кислота, причем вторая карбоксильная группа находится в пара-полложении, так как сказано, что заместители максимально удалены друг от друга.
Следовательно, структурная формула — 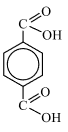 3) Уравнение реакции взаимодействия вещества А с метанолом (в присутствии серной кислоты) в соотношении 1:2 соответственно:
3) Уравнение реакции взаимодействия вещества А с метанолом (в присутствии серной кислоты) в соотношении 1:2 соответственно:
Задание 35. Пробный вариант 4
При сгораниии 13,7 г органического вещества А получили 15,68 л углекислого газа, 1,12 л азота (н.у.) и 6,3 г воды.
Известно, что вещество А содержит в составе одной молекулы 5 вторичных атомов углерода , один третичный и один первичный атом, а функциональная группа находится в пара-положении. Вещество А при реакции с парами хлороводорода в присутствии железа при нагревании переходит в органическое вещество Б немолекулярного строения.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества;
2) составьте структурную формулу вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции вещества А парами хлороводорода в присутствии железа при нагревании (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть1) исходное органическое вещество точно содержит в своём составе атомы элементов углерод, азот и водород, так как при сгорании этого вещества образуются углекислый газ, газ азот и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода, азота и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода, азота и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, n = V/Vm
m = n ∙ M,
n (CO2) = 15,68 л / 22,4 л/моль = 0,7 моль
n (С) = n (СО2) = 0,7 моль
m (C) = 0,7 моль ∙ 12 г/моль = 8,4 г
М(Н2О) = 18 г/моль
n (H2O) = 6,3 г / 18 г/моль = 0,35 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,35 моль = 0,7 моль
m (H) = 0,7 моль ∙ 1 г/моль = 0,7 г
n (N2) = 1,12 л / 22,4 л/моль = 0,05 моль
n (N) = 2 ∙ n (N2) = 2 ∙ 0,05 моль = 0,1 моль
m (N) = 0,1 моль ∙ 14 г/моль = 1,4 г
m (C) + m (H) + m (N) = 8,4 г + 0,7 г + 1,4 г = 10,5 г, что НЕ равно массе исходного вещества, а значит атомы кислорода присутствуют в веществе.
m (O) = 13,7 г – 10,5 г = 3,2 г
n (O) = 3,2 г / 16 г/моль = 0,2 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (N) : n (O) = 0,7 : 0,7 : 0,1 : 0,2 = 7 : 7 : 1 : 2
Следовательно молекулярная формула вещества: C7H7NO2.
2) Анализируя информацию о веществе А, можно предположить, что это вещество является ароматическим (по указанию первичных, вторичных и третичных атомов углерода). Также для определения класса/группы перебираем известные в школе кислородсодержащие соединения и делаем вывод, что под получившуюся молекулярную формулу подходят либо нитросоединение либо аминокислота. Но так как вещество реагирует с железом и хлороводородом, то узнаём реакцию Зинина, по которой нитрогруппа переходит в аминогруппу с последующей реакцией с кислотой и с образованием органической соли, которая и является веществом Б немолекулярного строения. Вариант с аминокислотой исключаем, так как для реакции аминокислоты с HCl железо не нужно.
2) следовательно, структурная формула: 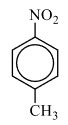 3) уравнение реакции вещества А парами хлороводорода в присутствии железа при нагревании с образованием органической соли Б:
3) уравнение реакции вещества А парами хлороводорода в присутствии железа при нагревании с образованием органической соли Б: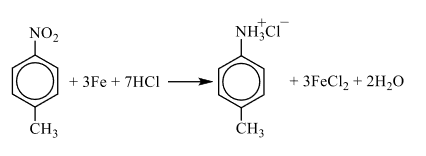
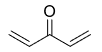
Задание 35. Пробный вариант 5
Вещество А содержит 65,06% углерода, 6,02% водорода, 28,92% кислорода по массе. Известно, что вещество А окисляется до бензойной кислоты. Также известно, что вещество А при взаимодействии с бромоводородом даёт бромопроизводное Б. При воздействии на это бромопроизводное Б спиртового раствора щёлочи происходит дегидрогалогенирование и образуется соль ненасыщенной кислоты.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции окисления вещества А перманганатом калия в присутствии серной кислоты (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть1. Общая формула вещества А – CxHyOz
x : y : z = 65,06/12 : 6,02/1 : 28,92/16 = 5,422 : 6,02 : 1,808 = 3 : 3,33 : 1 = 9 : 10 : 3. Следовательно, молекулярная формула С9Н10О3.
2. Соединение С9Н10О3 окисляется до бензойной кислоты, значит его основу составляет бензолное кольцо. Отсюда следует, что заместитель имеет три атома углерода. Так как в конце всех превращений (описанных в задаче) образуется соль ненасыщенной кислоты, то вещество А содержит карбоксильную группу. Из трёх атомов кислорода в веществе А два входят в состав карбоксила, а третий принадлежит спиртовому гидроксилу, так как вещество А при взаимодействии с бромоводородом образует бромпроизводное Б, что невозможно в случае наличия фенольного гидроксила. При взаимодействии на это бромпроизводное спиртового раствора щёлочи происходит дегидрогалогенирование и образуется соль ненасыщенной карбоновой кислоты, следовательно, спиртовой гидроксил находится в β-положении по отношению к карбоксильной группе, так как именно β-гидроксикислоты при нагревании отщепляют воду и образуют ненасыщенные соединения.
3. Уравнение реакции:
Задание 35. Пробный вариант 6
При сгорании органического вещества Н массой 7 г получено 8,96 л (н.у.) углекислого газа и 5,4 г воды. Известно, что вещество Н подвергается полному гидрированию при нагревании, повышенном давлении и в присутствии катализатора, в результате чего образуется предельный одноатомный первичный спирт В. Про исходное вещество Н также известно, что один из его концевых атомов углерода в молекуле находится в состоянии sp3-гибридизации.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества Н;
2) составьте структурную формулу вещества Н, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции полного гидрирования вещества Н при нагревании, повышенном давлении и в присутствии катализатора (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть1. Исходное органическое вещество Н точно содержит в своём составе атомы элементов углерод, водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Но так как в условии задачи сказано, что при гидрировании вещества Н (а это реакция с водородом) образуется спирт (в котором есть атомы кислорода), то делаем вывод, что исходное вещество Н точно содержит атомы кислорода. Разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, n = V/Vm
m = n ∙ M,
n (CO2) = 8,96 л / 22,4 л/моль = 0,4 моль
n (С) = n (СО2) = 0,4 моль
m (C) = 0,4 моль ∙ 12 г/моль = 4,8 г
М(Н2О) = 18 г/моль
n (H2O) = 54 г / 18 г/моль = 0,3 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,3 моль = 0,6 моль
m (H) = 0,6 моль ∙ 1 г/моль = 0,6 г
m (C) + m (H) = 4,8 г + 0,6 г = 5,4 г
m (O) = 7 г – 5,4 г = 1,6 г
n (O) = 1,6 г / 16 г/моль = 0,1 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 0,4 : 0,6 : 0,1 = 4 : 6 : 1
Следовательно молекулярная формула вещества: C4H6O.
- Как правило, спирты образуются при гидрировании либо альдегидов, либо кетонов. Но первичные спирты образуются из альдегидов, поэтому делаем вывод, что СНО-группа находится на конце. Составляя структурную формулу, замечаем, что не хватает атомов водорода, чтобы получить насыщенный альдегид. Поэтому понимаем, что альдегид ненасыщенный, т.е. содержит двойную связь (именно двойная связь подходит по числу атомов водорода в молекуле). Но так как сказано, что один из концевых атомов углерода в молекуле находится в состоянии sp3-гибридизации, делаем вывод, что двойная связь НЕ может быть на конце (так как атом углерода при двойной связи находится в состоянии sp2-гибридизации). Отсюда получаем, что кратная (двойная) связь отходит от второго атома углерода (между вторым и третьим).
3. Уравнение реакции:
Задание 35. Пробный вариант 7
Вещество А содержит 48% углерода, 4% водорода и 48% кислорода по массе. Известно, что вещество А относится к гетероциклическим соединениям и получается дегидратацией при нагревании вещества Б, которое не содержит третичных и четвертичных атомов углерода.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А путём дегидратации вещества Б при нагревании (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть- Общая формула вещества А – CxHyOz
x : y : z = 48/12 : 4/1 : 48/16 = 4 : 4 : 3. Следовательно, молекулярная формула С4Н4О3.
- Соединение С4Н4О3 является гетероциклическим, а значит в состав цикла входят не только атому углерода, но и атомы кислорода. Учитывая, что это вещество образуется путём дегидратации, то можно предположить, что вещество А получается из карбоновой кислоты, так как при дегидратации спиртов образуются алкены, а альдегиды и простейшие эфиры не подвергаются дегидратации . Но так как образуется цикл, то в веществе Б должно быть две карбоксильные группы. И так как по условию задачи сказано, что вещество Б не содержит третичные и четвертичные атомы углерода, то значит его цепочка прямая и неразветвлённая, а значит карбоксильные группы расположены по концам. Как следствие, будет образовываться пятичленный цикл вещества А.
Структурная формула вещества А: 
- 3. Уравнение реакции:
Задание 35. Пробный вариант 8
Неизвестное ациклическое органическое вещество содержит 73,17% углерода, 7,32% водорода и 19,51% кислорода по массе. Это вещество можно получить в реакции избытка спиртового раствора щёлочи с дихлорпроизводным, содержащим такое же число атомов углерода в молекуле как и неизвестное органическое вещество, причём атомы хлора располагаются по разным концам молекулы.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу неизвестного органического вещества;
2) составьте структурную формулу неизвестного органического вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения неизвестного органического вещества путём взаимодействия дихлорпроизводного с избытком спиртового раствора щёлочи (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть- Общая формула вещества А – CxHyOz
x : y : z = 73,17/12 : 7,32/1 : 19,51/16 = 6,098 : 7,32 : 1,219 = 5 : 6 : 1. Следовательно, молекулярная формула С5Н6О.
- Анализируя условие задачи, можно предположить, что неизвестное органическое вещество будет либо спиртом, либо альдегидом, либо кетоном, либо карбоновой кислотой, либо эфиром. Но так как сказано, что вещество является ациклическим и получается из дихлопроизводного, в котором атомы хлора располагаются по противоположным концам молекулы, то значит при щелочном гидролизе отщепляются две молекулы хлороводорода и по концам образуются двойные связи, и, значит, кислород находится по центру у третьего атома углерода, а значит это ненасыщенный кетон.
Структурная формула неизвестного вещества:
Задание 35. Пробный вариант 9
Устойчивое органическое соединение количеством 0,25 моль окислили водным раствором перманганата натрия. В результате образовались только карбонат натрия массой 8,798 г, гидрокарбонат натрия массой 14,028 г, оксид марганца (IV) массой 28,971 г и вода.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу неизвестного органического вещества;
2) составьте структурную формулу неизвестного органического вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции описанное в условии задачи (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернутьВидео-объяснение смотрите на Ютуб по ссылке или ниже
Задание 35. Пробный вариант 10
Вещество А содержит 72% углерода, 6,67% водорода и 21,33% кислорода по массе. Известно, что вещество А содержит два заместителя, которые максимально удалены друг от друга. Также известно, что вещество А получается при нагревании ацетилхлорида (хлорангидрид уксусной кислоты) с веществом Б, которое не вступает в реакции этерификации.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А путём взаимодействия ацетилхлорида с веществом Б при нагревании (используйте структурные формулы органических веществ).
Решение:
Развернуть/свернуть- 1. Общая формула вещества А – CxHyOz
x : y : z = 72/12 : 6,67/1 : 21,33/16 = 6 : 6,67 : 1,333 = 4,5 : 5 : 1 = 9 : 10 : 2. Следовательно, молекулярная формула С9Н10О2.
- Соединение С9Н10О2 является ароматическим, так как содержит небольшое число атомов водорода. Также по условию известно, что имеется два заместителя, которые максимально удплены друг от друга, а значит, что один из заместителей находится в пара-положении. Учитывая, что вещество А образуется путём взаимодействия с ацетилхлоридом, то можно предположить, что в первом заместителе содержится два атома углерода, а во втором – один. Учитывая, что исходное вещество Б не вступает в реакции этерефикации, но содержит один атом кислорода (так как один из атомов кислорода находится в ацетилхлориде), то оно относится к классу фенолов, в частности это пара-крезол. Отсюда получаем структурную формулу вещества А:

- Уравнение реакции:
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Возможные варианты задания 33 в ЕГЭ 2022
- Возможные варианты задания 34 в ЕГЭ 2022
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет и пробные (тренировочные) варианты ЕГЭ вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку

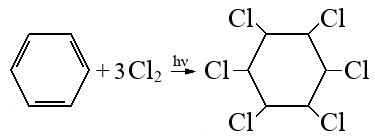

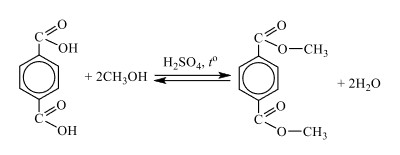
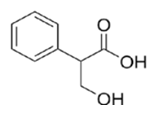
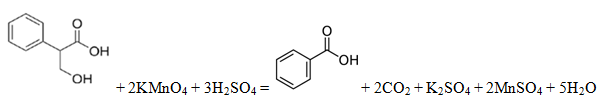

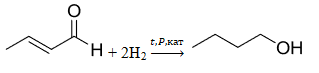

Спасибо Вам огромное за Ваш колоссальный труд и помощь нашим детям. Решаем и готовимся к экзамену с помощью вашего сайта. Помогите разобраться в одной задаче, пожалуйста!
Смесь алюминия и углерода ,массой 25г прокалили в электропечи. После окончания реакции к смеси полученной добавили 365г 20% HCI ,при этом осталось 3,4г нерастворившегося вещества. Рассчитайте массовые доли простых веществ в исходной смеси и м.д. соли в полученном растворе.
Заранее большое спасибо!!!
4Al + 3C = Al4C3 (уравнение 1)
Al4C3 + 12HCl = 4AlCl3 + 3CH4 (уравнение 2)
Нерастворившимся веществом может быть только избыточный углерод, который остался после первой реакции (если бы в избытке был бы алюминий, то он бы прореагировал бы с соляной кислотой и никакого нерастворившегося вещества не осталось бы, или если бы алюминий и углерод прореагировали бы без остатка в первой реакции, то тоже бы не осталось бы нерастворившегося вещества).
Но в задаче НЕ сказано о том, прореагировала ли вся соляная кислота или нет, не понятно: она в избытке или недостатке, поэтому решать будем через общую массу прореагировавшего углерода и алюминия. Для этого от общей массы смеси отнимкм массу непрореагировавшего избыточного углерода и потом распишем массу прореагировавшей смеси, приняв количество алюминия за х моль.
m (Al + C)прор = 25 г — 3,4 г = 21,6 г
Пусть в смеси было х моль алюминия (столько же и прореагировало, так как он был в недостатке)
По уравнению 1: если прореагировало х моль алюминия, то прореагировало 0,75х моль углерода (х * 3 / 4)
Переводим хим количества в массы и складываем их
27х + 0,75х*12 = 21,6
36х = 21,6
х = 0,6 моль (Al)
m (Al) = 0,6 моль * 27 г/моль = 16,2 г
w (Al) = 16,2 г / 25 г = 0,648 или 64,8%
w (Cl) = 100% — 64,8% = 35,2%
Ну а далее зная алюминий, вы по двум уравнениям находите хлород алюминия, потом массу конечного раствора и затем массовую долю. Думаю дальше вы сможете дорешать сами. Главное находя массу конечного раствора НЕ учитывайте нерастворившийся углерод и улетевший газ метан.
Удачи!
Вариант 5 в 35 задаче. Сказано что заместители в орто и пара положениях. Но в ответе это пара диметилбензол.
Здравствуйте. Спасибо за внимательность! Ошибку в условии исправил. И да, вы имели в виду вариант 6, а не 5
В первом образце задания 34 указана плотность раствора 0,591 г/мл. Но ведь никой раствор не может быть легче растворителя (воды! , у которой плотность 1 Г/мл)
Здравствуйте. Абсолютно верное замечание. Данная плотность вымышлена (просто было подобрано удобное число). Поэтому приношу извинения. Но на ход решения задачи эта теоретическая неточность НЕ влияет.