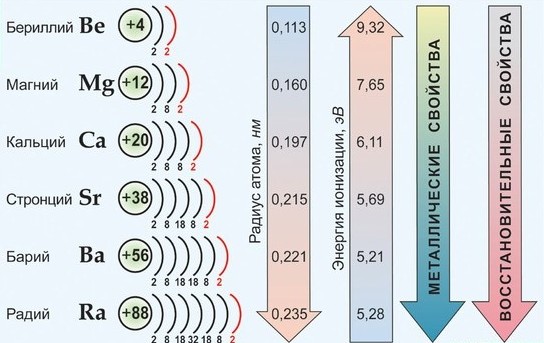
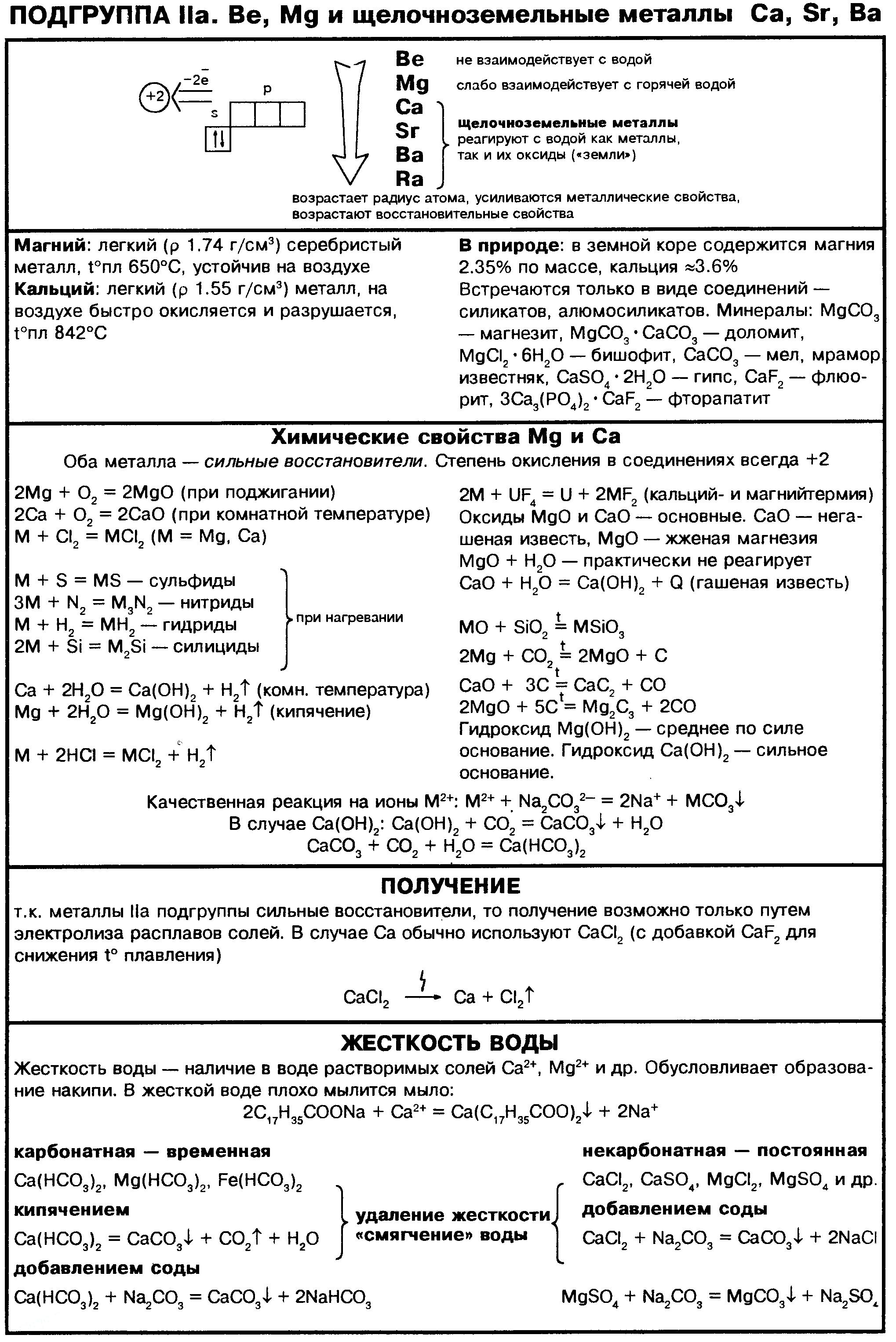
Главную подгруппу II группы составляют бериллий, магний, кальций, стронций, барий и радий. На внешнем электронном слое у них находится по два легко теряемых s-электрона. Во всех соединениях они проявляют степень окисления +2, их активность возрастает с увеличением атомного номера. Все они (за исключением бериллия, проявляющего амфотерные свойства) – металлы, по свойствам близкие к щелочным, их химические связи с неметаллами носят ионный характер. В свободном состоянии это твердые серебристо-белые вещества.
Общая характеристика элементов II а группы
Физические свойства простых веществ
Щелочноземельные металлы (по сравнению со щелочными металлами) обладают более высокими t°пл. и t°кип., потенциалами ионизации, плотностями и твердостью.
Химические свойства
1. Реакция с водой.
В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде. В отличие от них Ca, Sr и Ba растворяются в воде с образованием щелочей:
Mg + 2H2O –t°→ Mg(OH)2 + H2↑
Ca + 2H2O → Ca(OH)2 + H2↑
2. Реакция с кислородом.
Все металлы образуют оксиды RO, барий-пероксид – BaO2:
2Mg + O2 → 2MgO
Ba + O2 → BaO2
3. С другими неметаллами образуют бинарные соединения:
Be + Cl2 → BeCl2 (галогениды)
Ba + S → BaS (сульфиды)
3Mg + N2 → Mg3N2 (нитриды)
Ca + H2 → CaH2 (гидриды)
Ca + 2C → CaC2 (карбиды)
3Ba + 2P → Ba3P2 (фосфиды)
Бериллий и магний сравнительно медленно реагируют с неметаллами.
4. Все щелочноземельные металлы растворяются в кислотах:
Ca + 2HCl → CaCl2 + H2
Mg + H2SO4(разб.) → MgSO4 + H2
5. Бериллий растворяется в водных растворах щелочей:
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
6. Летучие соединения щёлочноземельных металлов придают пламени характерный цвет:
соединения кальция — кирпично-красный, стронция — карминово-красный, а бария — желтовато-зелёный.