Предлагаем вашему вниманию пятый пробный вариант для подготовки к ЦТ по химии 2019.
Скачать РТ 2018/2019 вариант 5
Вариант 5
Вариант содержит 50 заданий и состоит из части А (38 заданий) и части В (12 заданий). На выполнение всего теста отводится 150 минут. Необходимые справочные материалы – «Периодическая система химических элементов Д.И. Менделеева», «Растворимость кислот, оснований и солей в воде», Электрохимический ряд активности металлов» — приведены в конце теста.
При расчётах принять молярный объём газа (Vm) 22,4 дм3/моль. Значения относительных атомных масс химических элементов (кроме хлора, для которого Ar = 35,5) следует округлять до целого числа. При решении заданий можно пользоваться микрокалькулятором. Будьте внимательны! Желаем успеха!
Часть А
Для получения приближённого значения чисел в промежуточных расчётах округлите их до третьего знака после запятой по правилам округления. Конечный результат округлите, ориентируясь на числа, предложенные в ответе.
В каждом задании только ОДИН из предложенных вариантов ответа является верным. В бланке ответов под номером задания поставьте метку (х) в клеточке, соответствующей номеру выбранного варианта ответа.
А1. Большинство атомов элементов неметаллов на внешнем слое содержат число электронов, равное:
1) 1-2 2) 2-3 3) 3-4 4) 4-8
А2. Символы только элементов металлов приведены в рядах:
1) Ca, Zn, Cd 2) Te, As, B 3) Ga, In, Хе 4) Kr, Bi, Sb
А3. В формульной единицы карбида кальция СаС2 содержится столько же электронов, как и в атоме:
1) S 2) U 3) Si 4) Ge
А4. Ряд химических элементов, расположенных в порядке возрастания их атомного радиуса:
1) Sb → As → P 2) P → S → Cl
3) C → Si → Ge 4) Li → Be → B
А5. Как простое вещество, кремний упоминается в утверждении:
1) входит в состав карборунда;
2) образует очень прочные связи со фтором и кислородом
3) используется как восстановитель в металлургии
4) содержит 14 электронов
А6. Максимальная степень окисления фосфора в соединениях равна:
1) + 6 2) + 5 3) + 3 4) + 4
А7. Число атомов кислорода в навеске кристаллогидрата MgSO4∙7H2O массой 221,4 г составляет:
1) 2,408∙1023 2) 2,167∙1024
3) 5,96∙1024 4) 3,793∙1022
А8. В химической лаборатории ступка с пестиком используется для:
1) хранения жидких веществ или растворов
2) измельчения твёрдых веществ
3) упаривания растворов
4) закрепления пробирок и колб
А9. При электролизе водного раствора хлорида калия на аноде выделяется:
1) водород 2) калий
3) хлор 4) кислород.
А10. В стакан, подкрашенный лакмусом, добавили оксид стронция. Укажите цвет раствора до и после добавления оксида:
1) фиолетовый, красный 2) фиолетовый, синий
3) фиолетовый, жёлтый 4) красный, синий
А11. Даны вещества, формулы которых HCl, KI, NaBr, SO2, P, NaHSO4, H2S, NaF, F2,Na2SO3, FeS2. Укажите, сколько из них может вступать в окислительно-восстановительно реакцию с H2SO4 (конц.):
1) четыре 2) пять
3) шесть 4) семь
А12. Дана схема превращений . Первое превращение – реакция соединения, второе – реакция обмена. Укажите вещества А и В:
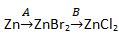
1) бромид железа (II), хлорид серебра
2) бром, хлорид калия
3) бром, хлорид ртути (II)
4) бромоводородная кислота, хлор
А13. НЕВЕРНЫ утверждения:
а) при нормальном давлении плотность воды максимальна при температуре 0 0С;
б) в ряду H2O, H2S, H2Se температура кипения веществ последовательно нарастает;
в) молекула воды – диполь;
г) со всеми металлами вода реагирует только при нагревании;
1) а, б, г 2) а, г 3) б, в 4) б, г
А14. Укажите уравнение качественной реакции на хлорид-ион:
1) Na+ + Cl— = NaCl 2) H+ + Cl— = HCl
3) Ag+ + Cl— = AgCl 4) 2Cl— + F2 = 2F— + Cl2
А15. Верными являются утверждения:
а) в отличие от O2 озон реагирует с Hg при 20 ˚С
б) озон более сильный окислитель, чем кислород
в) озон образуется при пропускании электрического разряда через кислород
г) при обычных условиях озон — жидкость тёмно-синего цвета
1) а, б, в 2) б, в 3) б, г 4) в, г
А16. Укажите справедливые утверждения:
а) кальций НЕ вытесняет магний из водных растворов солей магния;
б) в ряду Ca – Mg – Be восстановительные свойства металлов увеличиваются;
в) щелочные и щелочноземельные металлы относятся к элементам s –семейства;
г) при окислении всех щелочных металлов кислородом образуются только оксиды состава Э2О;
1) а, в 2) а, г 3) б, в 4) в, г
А17. Потребность редиски в химическом элементе азот составляет в среднем 195 кг/га. Масса аммиачной селитры (кг), которую необходимо внести на 3 га почвы для подкормки редиски азотом, равна:
1) 585 2) 793 3) 1671 4) 3343
А18. Известны тепловые эффекты следующих процессов:
2C2H2(г) + 5O2(г) = 4CO2(г) + 2H2O(ж) + 2600 кДж
H2O(ж) = H2O(г) – 40 кДж
Укажите, какую массу (г) воды можно испарить за счёт теплоты, полученной при полном сгорании ацетилена объёмом 89,6 дм3 (н.у.):
1) 72 2) 1170 3) 2340 4) 4680
А19. Превращения – голубой осадок → чёрный осадок → голубой раствор → красный металл – соответствуют схеме превращений:
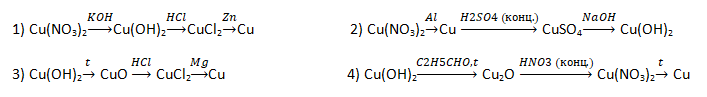
А20. При нагревании перманганата калия образуется (коэффициенты не указаны):
1) K2MnO4 + MnO2 + O2 2) K2O2 + MnO2 + O2
3) K2O + MnO2 + O2 4) K2MnO4 +MnO + O2
А21. В реакции некоторого вещества с раствором щелочи выделился газ. Этим веществом может быть:
1) Al2O3 2) AlCl3 3) Al(OH)3 4) Al.
А22. С наибольшей скоростью при обычных условиях протекает реакция:
1) Zn + НСl (5% р-р) 2) Zn + НСl (10% р-р)
3) Zn + НСl (20% р-р) 4) NaОН (5% р-р) + HCl (5% р-р)
А23. Реакция с участием воды, которая обратима при обычных условиях:
1) СН3СООСН3 + Н2О → СН3СООН + СН3ОН 2) SO3 + H2O → H2SO
3) 2К + 2Н2О → 2КОН + Н2 4) СаО + Н2О → Са(ОН)2
А24. Укажите факторы, которые заметно влияют на растворимость твердых веществ в жидкости:
а) давление;
б) природа жидкости;
в) температура;
г) природа вещества;
д) интенсивность перемешивания раствора;
е) степень измельчения вещества;
ж) масса вещества:
1) все из перечисленных 2) б, в, г
3) а, б, в, г 4) в, г, д, е
А25. Прозрачные растворы образуются при сливании растворов:
а) Ba(NO3)2 и K2CO3; б) MgSO4 и KF;
в) CaCl2 и NH4NO3; г) NaHCO3 и CaCl2;
1) а, в 2) б, в 3) б, г 4) в, г
А26. Сокращённому ионному уравнению Zn2+ + S2- = ZnS↓ соответствует взаимодействие:
1) Zn и S 2) Zn(OH)2 и K2S (p-p)
3) Zn(OH)2 и H2S (p-p) 4) ZnSO4 и Na2S (p-p)
А27. Полимер, реагирующий с бромной водой, это:
1) полистирол 2) полиэтилен
3) полибутадиен 4) поливинилхлорид
А28. Модель молекулы амина изображена на рисунке:

А29. Формулы только алканов записаны в ряду:
1) C2H2, C2H4, C2H6 2) C2H2, C3H4, C4H6
3) C2H6, C3H6, C4H8 4) C2H6, C3H8, C4H10
А30. Масса (г) органического вещества В, полученного с общим выходом 80% по схеме , равна:
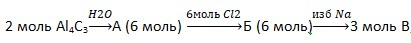
1) 24 2) 30 3) 72 4) 90
А31. Продуктом реакции бутена-1 с хлором является:
1) 2-хлорбутен-1 2) 1,2-дихлорбутан
3) 1,2-дихлорбутен-1 4) 1,1-дихлорбутан
А32. Свежеприготовленный осадок Сu(ОН)2 растворится, если к нему добавить:
1) пропандиол-1,2 2) пропанол-1
3) пропен 4) пропанол-2
А33. Наибольшая масса гидроксида калия вступит в реакцию с веществом массой 20 г:
1) С6H5OH 2) CH3(CH2)2CH(NH2)COOH
3) C3H7COOCH3 4) C15H31COOH
А34. Карбонильная группа >С=О входит в состав:
1) этиленгликоля, бензойной кислоты, пропановой кислоты
2) муравьиной кислоты, ацетона, этанола
3) этаналя, уксусной кислоты, этилацетата
4) аминоуксусной кислоты, бензола, пропаналя
А35. Из уксусной кислоты и пропанола-1 получится:
1) пропилэтиловый эфир 2) этилпропионат
3) пропилацетат 4) изопропилформиат
А36. Твердые жиры вступают в реакцию с:
1) бензолом 2) раствором сульфата меди (II)
3) глицерином 4) раствором гидроксида натрия
А37. Газообразным продуктом спиртового брожения глюкозы является:
1) СН4 2) СО2 3) O2 4) СО
А38. В схеме превращений C6H6 → X1 → X2 → [C6H5NH3]+ Cl—, вещества «X1» и «X2» соответственно:
1) C6H5NO2 и C6H5Cl 2) C6H5OH и C6H5Cl
3) C6H5OH и C6H5NO2 4) C6H5NO2 и C6H5NH2
Часть В
При решении задач в промежуточных расчётах для получения приближенного значения чисел округлите их до третьего знака после запятой по правилам округления, а конечный результат – до целого числа.
Единицы измерения числовых величин не указывайте.
Ответы, полученные при выполнении заданий, запишите в бланк ответов. Каждую букву, цифру пишите в отдельной клеточке (начиная с первой) по образцам, указанным в бланке.
В1. Кислородсодержащее органическое вещество А имеет относительную плотность паров по водороду 23. Вещество А реагирует с калием и уксусной кислотой, а с хлороводородом образует вещество Б. При нагревании до 170С с серной кислотой вещество А превращается в газообразный при н.у. углеводород В. Окисление А оксидом меди (II) при нагревании приводит к образованию органического вещества Г, которое при последующем каталитическом окислении превращается в вещество Д, содержащее такое же число атомов углерода в молекуле. Известно, что водный раствор Д окрашивает метилоранж в красный цвет. Найдите сумму молярных масс (г/моль) всех зашифрованных веществ.
В2. Установите соответствие между формулой соли и видом жесткости, которой она вызывает:
| Формула соли | Вид жесткости |
| 1) CaSO4 2) MgSO4 3) NaCl 4) NaHCO3 5) Ca(HCO3)2 6) Mg(HCO3)2 7) CaCl2 |
А) временная жесткость Б) постоянная жесткость В) не вызывает жесткость |
В ответе последовательно запишите буквы. Например: ААБВБВА.
В3. Для нейтрализации 10 г спиртового раствора, содержащего анилин и фенол, потребовалось 49,02 см3 раствора с массовой долей гидроксида калия 2,24% (плотность 1,02 г/см3). При добавлении к 10 г такого раствора избытка бромной воды образовалось 16,52 г осадка. Определите массовую долю анилина в исходном растворе.
В4. Для полного омыления растительного масла массой 42,6 г потребовался раствор гидроксида натрия массой 50 г с массовой долей NaOH 12%. При последующей обработке раствора избытком бромной воды получена смесь тетрабромпроизводного и дибромпроизводного в молярном соотношении 2:1, причём массовая доля натрия в одном из бромпроизводных составляет 3,698%. Укажите молярную массу (г/моль) дибромпроизводного.
В5. Определите сумму молярных масс (г/моль) органического вещества А и нерастворимого неорганического вещества Б, полученных в результате превращений:
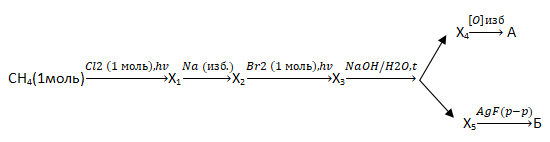
В6. Определите сумму молярных масс (г/моль) кремнийсодержащих веществ А и Б, полученных в результате превращений:

В7. Дан перечень веществ: графит, фосфин, фуллерен, нашатырь, гашёная известь, оксид углерода (IV), силикат кальция, аммиачная силитра, сернистый газ, хлор. Классифицируйте эти вещества. Ответ запишите в виде последовательности цифр следующим образом: сначала число простых веществ, затем число летучих водородных соединений, потом число высших оксидов и, наконец, число солей соответственно, например: 2342.
В8. Установите соответствие между веществом и реактивом, который нужно использовать для качественного определения (все вещества представлены водными растворами).
| Вещество | Реактив |
| А) углекислый газ Б) хлорид магния В) бромид стронция Г) гидрокарбонат натрия Д) фторид калия |
1) нитрат натрия 2) иодид аммония 3) серная кислота 4) гидроксид бария |
Ответ запишите в виде последовательности букв и цифр, соблюдая алфавитную последовательность, например: А1Б3В3Г2Д4.
В9. После упаривания воды из раствора гидроксида натрия массой 200 г с массовой долей щёлочи 10%, общее число атомов в растворе уменьшилось в 3 раза. Определите массовую долю гидроксида натрия в конечном растворе.
В10. При частичном термическом разложении нитрата меди (II) массой 15,04 г получили твёрдый остаток массой 8,56 г. Найдите степень разложения (%) нитрата меди (II).
В11. Рассчитайте объём (дм3, н.у.) углекислого газа, который необходимо добавить к смеси, состоящей из метана объёмом 2 дм3 (н.у.) и угарного газа объёмом 4 дм3 (н.у.), чтобы её плотность по гелию возрасла на 21%.
В12. Сплавы ртути с разными металлами называют амальгамами. При взаимодействии 10 г амальгамы натрия с водой получен раствор щелочи. Для нейтрализации этого раствора потребовалось 50 см3 раствора одноосновной кислоты концентрации 0,5 моль/дм3. Определите объём (дм3, н.у.) озонированного кислорода, который может при обычных условиях (20С) прореагировать с ртутью из исходной амальгамы, если объёмная доля озона в озонированном кислороде равна объёмной доле кислорода в воздухе.
Ответы:
Часть А
- 4
- 1
- 4
- 3
- 3
- 2
- 3
- 2
- 3
- 2
- 3
- 3
- 4
- 3
- 1
- 1
- 3
- 3
- 3
- 1
- 4
- 4
- 1
- 2
- 4
- 4
- 3
- 2
- 4
- 3
- 2
- 1
- 1
- 3
- 3
- 4
- 2
- 4
Часть В
- 243
- ББВВААБ
- 28
- 436
- 248
- 194
- 3113
- А4Б4В3Г3Д4
- 27
- 75
- 2
- 5
Посмотреть видео-объяснения всех заданий ЦТ и РТ, начиная с 2004 года, вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»
- Посмотреть все пробные варианты РТ 2018/2019 вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
