Скачать Пробный вариант 2. ЕГЭ 2020 по химии с ответами в формате pdf
Вариант 2
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
1) Li; 2) Cs; 3) Ba; 4) O; 5) F.
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
- Определите, в атомах каких из указанных элементов связь валентных электронов с ядром наиболее слабая. Запишите в поле ответа номера выбранных элементов.
- Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке увеличения радиуса их простых ионов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
- Из числа указанных в ряду элементов выберите два элемента, которые НЕ проявляют высшую степень окисления, равную номеру группы. Запишите в поле ответа номера выбранных элементов.
- Из предложенного перечня выберите два соединения, которые имеют немолекулярное строение.
1) хлорид иода (III)
2) иод
3) гидроксид калия
4) уксусная кислота
5) красный фосфор
Запишите в поле ответа номера выбранных соединений.
- Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА |
| А) Ca | 1) соли средние |
| Б) CaHPO4 | 2) металлы |
| В) He | 3) благородные газы |
| 4) соли кислые |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует оксид кремния (IV).
1) P2O5
2) CaCO3
3) H2O
4) HF
5) HCl
Запишите в поле ответа номера выбранных веществ.
- В одну из пробирок с раствором хлорида меди (II) добавили раствор сильного электролита Х, а в другую – раствор слабого электролита Y. В результате в каждой из пробирок НЕ наблюдали видимых изменений. Из предложенного перечня выберите вещества Х и Y, которые могут подходить под описание выше.
1) нитрат калия
2) нитрат серебра (I)
3) гидроксид калия
4) фосфорная кислота
5) уксусная кислота
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
- Установите соответствие между названиями оксидов и реагентами, с каждым из которых они могут взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ОКСИДА | РЕАГЕНТЫ |
| А) оксид углерода (IV) | 1) C, HNO3, Cu |
| Б) оксид меди (II) | 2) Al, Cr2O3, H2O |
| В) оксид бария | 3) Mg, Sr(OH)2, H2O |
| Г) оксид углерода (II) | 4) KOH, Cl2, O2 |
| 5) CrO, CO2, H2O | |
| 6) H2O, SiO2, HCl |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) KOH + SO2 (изб.) | 1) KOH + H2 |
| Б) KOH (изб.) + SO2 | 2) K2SO3 + H2O |
| В) K2O + H2O | 3) KHSO3 |
| Г) KOH + H2SO4 | 4) K2SO4 + H2O |
| 5) KHSO4 | |
| 6) KOH |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) оксид алюминия
2) бромоводород
3) бромноватистая кислота
4) бромид алюминия
5) тетрагидроксоалюминат натрия
Запишите в таблицу номера веществ под соответствующими буквами.
- Установите соответствие между формулой вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
| А) NH2 – CH2 – COOH
Б) C4Н8 В) C3H6O2 |
1) органическая кислота
2) углеводород 3) амфотерное вещество 4) амин |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два вещества, которые могут существовать в виде цис- и транс-изомеров.
1) этилен
2) 2-метилбутадиен-1,3
3) бутен-1
4) бутен-2
5) пентадиен-1,3
Запишите в поле ответа номера выбранных веществ.
- При взаимодействии вещества C3H6 с хлором при определённых учсловиях выделился хлороводород. Из предложенного перечня выберите класс исходного вещества и тип реакции.
1) алканы
2) алкены
3) алкины
4) замещения
5) присоединения
Запишите в поле ответов номера выбранных ответов.
- Из предложенного перечня выберите две пары веществ, в которых каждое из веществ реагирует с этанолом.
1) Na и HCOOH
2) NaOH и KBr
3) CuO и O2
4) CH4 и C2H6
5) Na2O и Al2O3
Запишите в поле ответа номера выбранных пар веществ.
- Из предложенного перечня выберите два вещества, с которыми НЕ реагирует рибоза.
1) изопропилбензол
2) азотная кислота (конц.)
3) 1,3,5-трибромбензол
4) этанол (Н+)
5) уксусный ангидрид
Запишите в поле ответа номера выбранных веществ.
- Установите соответствие между схемой реакции и продуктом этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) CH3CH2COOCH3
2) CH3CH2COOH
3) CH3CH2CH2Br
4) CH3CH2CH2OH
5) CH3COOCH2CH3
Запишите в таблицу номера веществ под соответствующими буквами.
- Из предложенного перечня выберите две схемы превращений, которые можно осуществить последовательно используя реакции ОВР, обмена и разложения.
1) Fe → FeSO4 → FeCl2 → Fe
2) Cu → Cu(NO3)2 → Cu(OH)2 → CuO
3) BaO → Ba(OH)2 → Ba(HCO3)2 → CO2
4) Zn(NO3)2 → Zn → K2[Zn(OH)4] → ZnSO4
5) Al → AlCl3 → Al(OH)3 → Al2O3
Запишите в поле ответа номера выбранных схем превращений.
- Из предложенного перечня выберите два вещества, которые будут взаимодействовать с водой с наибольшей скоростью.
1) железо
2) магний
3) натрий
4) алюминий
5) барий
Запишите в поле ответа номера выбранных внешних воздействий.
- Установите соответствие между химическим превращением и окислительно-восстановительными свойствами кислорода, которые он проявляет в этом превращении: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ХИМИЧЕСКОЕ ПРЕВРАЩЕНИЕ | ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА |
| А) растворение песка в фтороводородной кислоте | 1) является только восстановителем |
| Б) взаимодействие фтора с водой | 2) является и окислителем, и восстановителем |
| В) растворение хлора в гидроксиде калия | 3) не проявляет окислительно-восстановительных свойств |
| 4) является только окислителем |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названием соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) сульфид натрия | 1) сера и водород |
| Б) сульфат цинка | 2) калий и сера |
| В) хлорид цинка | 3) водород, хлор, цинк |
| Г) фторид цинка | 4) кислород, цинк, водород |
| 5) цинк и фтор | |
| 6) цинк и сернистый газ |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между формулой соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
| А) HCOOK | 1) гидролизуется по катиону |
| Б) K2S | 2) гидролизуется по аниону |
| В) Al2S3 | 3) гидролизу не подвергается |
| Г) NH4NO2 | 4) гидролизуется по катиону и аниону |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между уравнением обратимой реакции и направлением смещения химического равновесия при понижении давления: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) FeO (тв) + CO (г) ↔ Fe (тв) + CO2 (г) | 1) смещается в сторону продуктов реакции |
| Б) 2SO2 (г) + O2 (г) ↔ 2SO3 (г) | 2) смещается в сторону исходных веществ |
| В) 2CO2 (г) ↔ 2CO (г) + O2(г) | 3) практически не смещается |
| Г) H2 (г) + Br2 (г) ↔ 2HBr (г) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между двумя веществами, с помощью которого можно различить эти вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВА | РЕАКТИВ |
| А) 2-гидрокси-2-метилпропановая кислота и молочная кислота | 1) Cu(OH)2 |
| Б) изопрен и пентан | 2) NaHCO3/H2O |
| В) этанол и пропандиол-1,2 | 3) KMnO4/H+ |
| Г) метанол и глицерин | 4) FeCl3 |
| 5) NaNO3/H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между веществом и основной областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ОБЛАСТЬ ПРИМЕНЕНИЯ |
| А) SiO2 | 1) производство красителей |
| Б) C2H2 | 2) сварка и резка металлов |
| В) H2O2 | 3) производство стекла |
| 4) антисептик |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Вычислите массу бромида калия (в граммах), которую следует растворить в 180,0 г раствора с массовой долей этой соли 8%, чтобы массовая доля бромида калия возросла в 1,5 раза. (Запишите число с точностью до сотых.)
- Термохимическое уравнение реакции разложения известняка имеет вид:
CaCO3 (тв) → CaO (тв) + CO2 (г) – 157 кДж.
Вычислите, сколько теплоты (в кДж) затрачивается на разложение 1 кг известняка. (Запишите число с точностью до целых.)
- Вычислите массу железа (в граммах), необходимого для окисления до Fe3O4 кислородом объёмом 89,6 л (н.у.). (Запишите число с точностью до целых.)
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
сульфат натрия, пероксид водорода, карбонат кальция, иодноватая кислота, хлорид бария, гидроксид калия. Допустимо использование водных растворов веществ.
- Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с выпадением осадка тёмно-фиолетового цвета и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
- Из предложенного перечня веществ выберите нерастворимую соль и вещество, которое вступает с этой нерастворимой солью в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
- Питьевую соду обработали избытком соляной кислоты. Выделившийся газ пропустили над раскалённым углём. В результате чего образовался новый газ, который затем смешали с сернистым газом при нагревании. Затем твёрдый продукт реакции полностью растворили в концентрированном растворе гидроксида натрия. Напишите уравнения четырёх описанных реакций.
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
- В раствор нитрата серебра (I) массой 250 г поместили медную пластинку массой 80 г. После полного вытеснения серебра пластинку вынули, высушили и взвесили. Её масса увеличилась на 3,8%. Оставшийся раствор подвергли электролизу с инертными электродами до полного расходования соли. Рассчитайте массовую долю растворённого вещества в конечном растворе после электролиза (растворимостью газов пренебречь). В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических венличин).
- Неизвестное органическое вещество содержит 17,98% углерода, 2,25% водорода и 79,77% хлора по массе. Известно, что в этом веществе все атомы хлора находятся у одного атома углерода и это вещество подвергается щелочному гидролизу.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение щелочного гидролиза вещества в присутствии избытка гидроксида калия (используйте структурные формулы органических веществ).
Система оценивания экзаменационной работы по химии
Часть 1
За правильный ответ на каждое из заданий 1–6, 11–15, 19–21, 26–29 ставится 1 балл.
Задание считается выполненным верно, если экзаменуемый дал правильный ответ в виде последовательности цифр или числа с заданной степенью точности.
Задания 7–10, 16–18, 22–25 считаются выполненными верно, если правильно указана последовательность цифр.
За полный правильный ответ заданий 7–10, 16–18, 22–25 ставится 2 балла; если допущена одна ошибка – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
| Номер задания | Правильный ответ |
| 1 | 23 |
| 2 | 154 |
| 3 | 45 |
| 4 | 35 |
| 5 | 243 |
| 6 | 24 |
| 7 | 15 |
| 8 | 3164 |
| 9 | 3264 |
| 10 | 24 |
| 11 | 321 |
| 12 | 45 |
| 13 | 24 |
| 14 | 13 |
| 15 | 13 |
| 16 | 2563 |
| 17 | 2116 |
| 18 | 12 |
| 19 | 25 |
| 20 | 35 |
| 21 | 313 |
| 22 | 1434 |
| 23 | 2244 |
| 24 | 3213 |
| 25 | 3311 |
| 26 | 324 |
| 27 | 8,18 |
| 28 | 1570 |
| 29 | 336 |
Часть 2
Критерии оценивания заданий с развёрнутым ответом
За выполнение заданий 30, 31 ставится от 0 до 2 баллов; задания 35 – от 0 до 3 баллов; заданий 32 и 34 – от 0 до 4 баллов; задания 33 – от 0 до 5 баллов.
Задание 30
Вариант ответа:
2HIO3 + 5H2O2 → I2↓ + 5O2↑ + 6H2O
1 2I+5 + 10ē → I20
5 2O-1 – 2ē → O20
Пероксид водорода или кислород в степени окисления -1 является восстановителем.
Иодноватая кислота или иод в степени окисления +5 – окислителем
Задание 31
Вариант ответа:
CaCO3 + 2HIO3 = Ca(IO3)2 + H2O + CO2
CaCO3 + 2H+ + 2IO3— = Ca2+ + 2IO3— + H2O + CO2
CaCO3 + 2H+ = Ca2+ + H2O + CO2
Задание 32
Вариант ответа:
NaHCO3 + HCl = NaCl + H2O + CO2
CO2 + C = 2CO
CO + SO2 = 2CO2 + S
3S + +6NaOH = Na2SO3 + 2Na2S + 3H2O
или 4S + 6NaOH = Na2S2O3 + 2Na2S + 3H2O
Задание 33
Примечание. Допустимо использование структурных формул разного вида (развёрнутой, сокращённой, скелетной), однозначно отражающих порядок связи атомов и взаимное расположение заместителей и функциональных групп в молекуле органического вещества.
Задание 34
Объяснение этой задачи вы можете найти на Ютуб по ссылке
Ответ: 1%
Задание 35
Найдем соотношение количества вещества углерода, водорода и хлора.
Примем массу соединения за 100 грамм, тогда количество вещества элементов следующее:
n(С) = 17,98/12 = 1,5
n(Сl) = 79,77/35,5 = 2,25
n(H) = 2,25/1 = 2,25
Соотношение углерода к хлору и водороду 1,5 : 2,25 : 2,25 = 1 : 1,5 : 1,5 = 2 : 3 : 3
Молекулярная формула вещества C2H3Cl3
Уравнение щелочного гидролиза в избытке гидроксида калия:
CH3-CCl3 + 4KOH = CH3COOK + 3KCl + 2H2O.
Также вы можете скачать:
- Пробный вариант №1 ЕГЭ 2020 г. (аналог демонстрационного варианта ЕГЭ 2020 г.) с ответами в формате pdf
- Пробный вариант 2. ЕГЭ 2020 по химии с ответами в формате pdf
- Демонстрационный вариант ЕГЭ 2020 (с сайта ФИПИ)
- Кодификатор ЕГЭ 2020 (с сайта ФИПИ)
- Спецификация ЕГЭ 2020 (с сайта ФИПИ)
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку



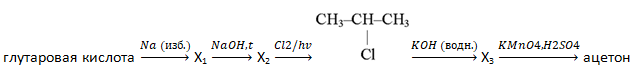
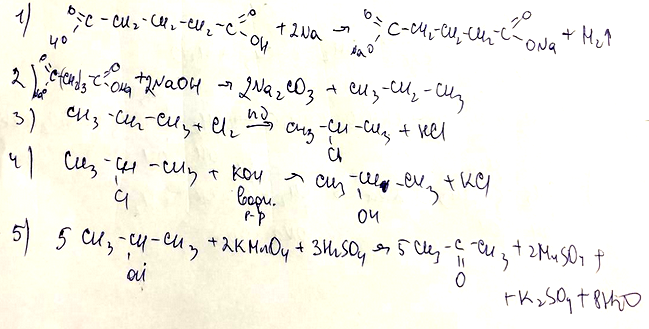
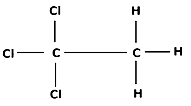
доброго времени суток! обьясните, пожалуйста, почему во 2 номере ответ 154?
Здравствуйте. Данные элементы образуют простые ионы Li(+), O(2-) и F(-). У атома лития на внешнем слое был один электрон, а у иона его нет, то есть исчез весь второй слой, остался только заполненный первый электронный слой, поэтому у иона лития самый саленький радиус. А при образовании ионов кислорода и фтора, к ним присоединялись электроны, поэтому их радиус стал больше, чем у соответствующих атомов. Изначально у атома кислорода радиус больше, чем радиус атома фтора, также при образовании ионов к кислороду пришло 2 электрона, к фтору — 1, поэтому радиус иона кислорода больше, чем радиус иона фтора. Итак, в порядке увеличения радиуса простых ионов идут элементы Li, F, O