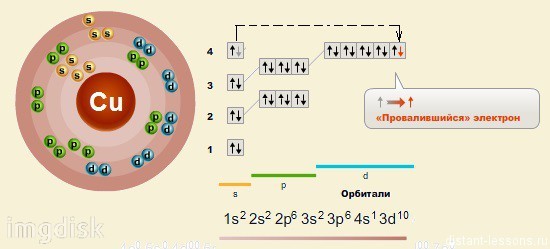
Медь расположена в IB группе Периодической системы химических элементов Д.И. Менделеева. В четвертом периоде медь является предпоследним d-элементом, её валентные электроны 3d94s2, однако вследствие устойчивости d10-состояния энергетическим более выгодным оказывается переход одного d-электрона на 4s-подуровень, поэтому валентные электроны меди имеют следующую конфигурацию: 3d104s1. В соединениях для меди характерная степень окисления +2, возможно проявление степеней окисления +1 и +3.
Физические свойства меди
Медь – пластичный, розовато-красный металл с металлическим блеском. Обладает высокой тепло- и электропроводностью, по значению электропроводности уступает только серебру. Температура плавления 1083°С, температура кипения 2567°С, плотность 8,92 г/см3.
На воздухе медь покрывается плотной зелено-серой пленкой основного карбоната, которая защищает её от дальнейшего окисления.
Химические свойства меди
С кислородом в зависимости от температуры взаимодействия медь образует два оксида:
2Cu + O2 = 2CuO (черный цвет)
При температуре около 150 оС металл покрывается темно-красной пленкой оксида меди (I):
4Cu + O2 = 2Cu2O
При нагревании с фтором, хлором, бромом образуются галогениды меди (II):
Cu + Br2 = CuBr2;
с йодом – образуется йодид меди (I):
2Cu + I2 = 2CuI.
Cu + S = CuS
4Cu + SO2= Cu2S + 2CuO
4Cu + 2NO2 = 4CuO + N2
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов медь расположена после водорода, поэтому она не взаимодействует с растворами разбавленной соляной и серной кислот и щелочей.
Растворяется в разбавленной азотной кислоте с образованием нитрата меди (II) и оксида азота (II):
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
Реагирует с концентрированными растворами серной и азотной кислот с образованием солей меди (II) и продуктов восстановления кислот:
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O;
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O.
С концентрированной горячей соляной кислотой:
Получение
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз.
Пирометаллургический метод
Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Халькопиритное сырье содержит 0,5-2,0 % Cu. После флотационного обогащения исходной руды концентрат подвергают окислительному обжигу при температуре 1400°:
Затем обожженный концентрат подвергают плавке на штейн. В расплав для связывания оксида железа добавляют кремнезём:
Образующийся силикат в виде шлака всплывает и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезема выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической меди:
Получаемая черновая медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкисленного раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
Гидрометаллургический метод
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом:
Электролизный метод
Электролиз раствора сульфата меди:


![{\displaystyle {\mathsf {2Cu+4HCl\longrightarrow \ 2H[CuCl_{2}]+H_{2}\uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cc80bfb324a1e02cf0b53b9c94e705f56502ee4d)









