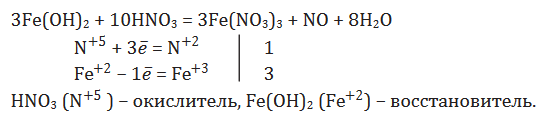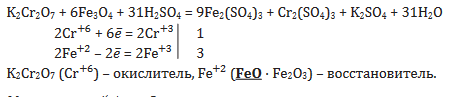Окислительно-восстановительные реакции. Часть 3
Предлагаем вам сборку заданий 29 формата ЕГЭ 2022 по теме Окислительно-восстановительные реакции. Ответы вы найдёте внизу страницы.
ВНИМАНИЕ — в ЕГЭ 2022 года это будет задание 29
Задание 1
Задание 2
 Задание 3
Задание 3
Задание 4
 Задание 5
Задание 5
 Задание 6
Задание 6
 Задание 7
Задание 7
 Задание 8
Задание 8
 Задание 9
Задание 9
 Задание 10
Задание 10
Задание 11
 Задание 12
Задание 12
Задание 13
Задание 14
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
перманганат калия, гидрокарбонат калия, сульфит калия, сульфид меди (II), гидроксид калия, пероксид водорода. Допустимо использование водных растворов веществ.
- Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора. Выделение осадка или газа в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Задание 15
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
сульфат натрия, пероксид водорода, карбонат кальция, иодноватая кислота, хлорид бария, гидроксид калия. Допустимо использование водных растворов веществ.
- Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с выпадением осадка тёмно-фиолетового цвета и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Задание 16
Задание 17
Задание 18
Для выполнения задания используйте следующий перечень веществ: сульфит калия, гидроксид меди (II), хлор, хлороводород, оксид фосфора (III), гидроксид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется две соли, содержащие в кислотных остатках атомы разных химических элементов, но имеющие одинаковый катион металла. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Задание 19
Для выполнения задания используйте следующий перечень веществ: оксид меди (II), фторид калия, сернистый газ, хлор, хлорид железа (II), гидроксид натрия. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется бесцветный раствор и выпадает бурый осадок. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Задание 20
Для выполнения задания используйте следующий перечень веществ: иодид калия, гидроксонитрат меди (II), концентрированная серная кислота, серебро, хлорид натрия, гидроксид стронция. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми одними из продуктов являются кислая соль и три вещества молекулярного строения. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Задание 21
Для выполнения задания используйте следующий перечень веществ: иодат калия, гидразин, хлорид алюминия, магний, карбонат натрия, фосфат аммония. Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми одна молекула восстановителя отдаёт 4 электрона, а окислитель восстанавливается до минимальной степени окисления. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Задание 22
Для выполнения задания используйте следующий перечень веществ соляная кислота, гидроксид калия, азотная кислота, платина, оксид цинка, фосфорная кислота: Допустимо использование водных растворов веществ.
Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми выделяется бесцветный газ. Причём одна структурная единица восстановителя отдаёт 4 электрона, а окислителя – принимает 3 электрона. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
Ответы:
Задание 14
Задание 15
Вариант ответа:
2HIO3 + 5H2O2 → I2↓ + 5O2↑ + 6H2O
1 2I+5 + 10ē → I20
5 2O-1 – 2ē → O20
Пероксид водорода или кислород в степени окисления -1 является восстановителем.
Иодноватая кислота или иод в степени окисления +5 – окислителем
Задание 16
16HCl + 2KMnO4 → 5Cl2 + 2MnCl2 + 2KCl + 8H2O
2 Mn+7 + 5ē → Mn+2
5 2Cl-1 – 2ē → Cl20
Хлороводород или хлор в степени окисления -1 является восстановителем.
Перманганат калия или марганец в степени окисления +7 –окислителем
Задание 17
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
2 Cr+3 – 3ē → Cr+6
3 2O-1 + 2ē → 2O-2
Гидроксид хрома (III) или хром в степени окисления +3 является восстановителем.
Пероксид водорода или кислород в степени окисления –1 –окислителем
Задание 18
- P2O3 + 2Cl2 + 10NaOH = 2Na3PO4 + 4NaCl + 5H2O
2P+3 – 4e = 2P+5 1
Cl20 + 2e = 2Cl— 2
Хлор в степени окисления 0 (или Cl2) является окислителем.
Фосфор в степени окисления +3 (или P2O3) является восстановителем.
Задание 19
- 2FeCl2 + 6NaOH + Cl2 = 2Fe(OH)3 + 6NaCl
Fe+2 – 1e = Fe+3 2
Cl20 + 2e = 2Cl-1 1
Хлор в степени окисления 0 (или Cl2) является окислителем.
Железо в степени окисления +2 (или FeCl2) является восстановителем.
Задание 20
8KI + 9H2SO4 = 8KHSO4 + 4I2↓ + H2S↑ + 4H2O (допустимо образование K2SO4)
2I-1 – 2e = I20 4
S+6 + 8e = S-2 1
Сера в степени окисления +6 (или H2SO4) является окислителем.
Иод в степени окисления -1 (или KI) является восстановителем.
Задание 21
3N2H4 + 2KIO3 = 2KI + 3N2↑ + 6H2O
2N-2 – 4e = N20 3
I+5 + 6e = I-1 2
Иод в степени окисления +5 (или KIO3) является окислителем.
Азот в степени окисления -2 (или N2H4) является восстановителем.
Задание 22
3Pt + 4HNO3 + 12HCl = 3PtCl4 + 4NO↑ + 8H2O
Pt0 – 4e = Pt+4 3
N+5 + 3e = N+2 4
Азот в степени окисления +5 (или HNO3) является окислителем.
Платина в степени окисления 0 (или Pt) является восстановителем.
Также предлагаем вам плейлист видео-уроков и видео-объяснений заданий на эту тему:
Также:
- Посмотреть реальные, досрочные и пробные варианты ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ вы можете здесь, нажав на эту строку
- Все видео-объяснения вы можете найти на YouTube канале, нажав на эту строку