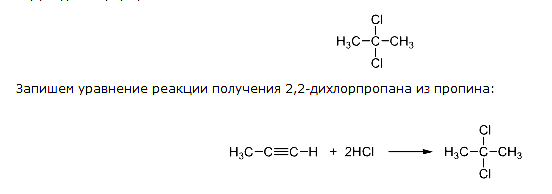Реальный ЕГЭ по химии 2018. Задание 34. Вариант 1. При термической обработке нитрата меди (II) массой 94 г часть вещества разложилась и выделилось 11,2 л смеси газов. К полученному твердому остатку добавили 292 г 10 % раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
Реальный ЕГЭ по химии 2018. Задание 34. Вариант 2. При прокаливании смеси карбоната натрия и карбоната магния до постоянной массы выделилось 4,48 л газа. Твердый остаток полностью прореагировал с 73 г 25%-ого раствора соляной кислоты. Рассчитайте массовую долю карбоната натрия в исходной смеси.
Реальный ЕГЭ по химии 2018. Задание 34. Вариант 9. При проведении электролиза 360 г 15 % раствора хлорида меди (II) процесс прекратили, когда на аноде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 66,6 г. Вычислите массу 10 %-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Реальный ЕГЭ по химии 2018. Задание 34. Вариант 14. Электролиз 640 г 15 % раствора сульфата меди (II) остановили после того, когда, масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 400 г 20%-ого раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
Реальный ЕГЭ по химии 2018. Задание 35. Вариант 3. При сгорании бескислородного органического вещества образуется 26,4 г СО2, 5,4 г Н2О и 13,44 л НСl. Это вещество можно получить взаимодействием соответствующего углеводорода с избытком НСl. Определите молекулярную и структурную формулу вещества.
Реальный ЕГЭ по химии 2018. Задание 35. Вариант 4. При сгорании 9 грамм вещества, несодержащего кислород образуется 12,6 г воды и 2,24 л азота и углекислого газа. Это вещество может быть получено при восстановлении нитросоединения водородом в присутствии катализатора. Определите молекулярную и структурную формулу вещества.
Реальный ЕГЭ по химии 2018. Задание 35. Вариант 8. При сгорании 1,18 г вторичного амина образуется 1,344 л углекислого газа, 1,62 г воды и азота. Определите молекулярную и структурную формулу вещества.
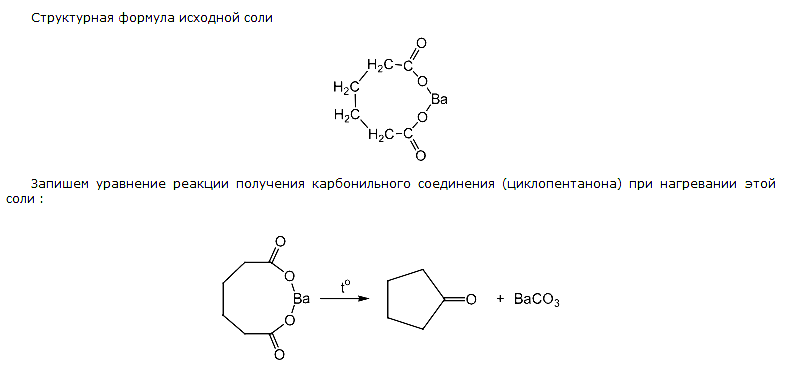
Реальный ЕГЭ по химии 2018. Задание 35. Вариант 10. Соль органической кислоты содержит 5,05% водорода, 42,42% углерода, 32,32% кислорода и 20,21% кальция. При нагревании этой соли образуется карбонильное соединение. Определите молекулярную и структурную формулу вещества.
Досрочный ЕГЭ по химии 2018. Задание 34. При прокаливании смеси карбоната магния и карбоната натрия до постоянной массы выделилось 4,48 л газа. Полученный твердый остаток полностью растворили в 73 г 25% соляной кислоты. Определите массовую долю (%) карбоната натрия в исходной смеси.
При решении записывайте уравнения реакций, которые указаны в условии задачи, и приводите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Досрочный ЕГЭ по химии 2018. Задание 35. При сгорании 21,6 г органического вещества выделилось 31,36 л углекислого газа и 14,4 г воды. Данное вещество вступает в реакцию этерификации с уксусной кислотой.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества.
2) составьте молекулярную формулу органического вещества.
3) составьте структурную формулу органического вещества, которая однозначно отражает порядок связи атомов в его молекуле.
4) напишите уравнение реакции этого вещества с уксусной кислотой.
Досрочный ЕГЭ по химии 2018. Задание 35. Вариант 2. При сгорании 16,96 г органического вещества выделилось 28,672 л углекислого газа и 14,4 г воды. Данное вещество при взаимодействии с перманганатом калия подкисленным , образует двухосновную кислоту и карбоксильные группы в ней расположены рядом у соседних атомов углерода.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества.
2) составьте молекулярную формулу органического вещества.
3) составьте структурную формулу органического вещества, которая однозначно отражает порядок связи атомов в его молекуле.
4) напишите уравнение реакции этого вещества с подкисленным раствором перманганата калия.
Реальный ЕГЭ по химии 2018. Задание 34. Вариант 3. При нагреванииобразца нитрата серебра(I) часть вещества разложилась, при этом образовался твердый остаток массой 88 г. К этому остатку добавили200 г 20%-ного раствора соляной кислоты, в результате чего образовался раствор массой 205,3 г с массовой долей соляной кислоты 15,93 %. Определите объем смеси газов, выделившейся при разложении нитрата серебра(I).
Решение.
- Запишем уравнение разложения нитрата серебра (I):
2AgNО3→ 2Ag + 2NО2 + O2+{AgNО3}ост. (1)
где {AgNO3}ост. – неразложившаяся часть нитрата серебра (I).
- Таким образом, твердый остаток – это смесь образовавшегося серебра и оставшегося нитрата серебра (I).
- С соляной кислотой реагирует только нитрат серебра (I):
AgNО3+ HCl → AgCl↓ + HNO3(2)
- Вычислим массу и количество вещества соляной кислоты в ее исходном растворе:
m(HCl)иcx. = 20г ∙ 0,2 = 40г
n(HCl)иcx.= 40г / 36,5 г/моль = 1,1моль
- Вычислим массу и количество вещества соляной кислоты в образовавшемся растворе:
m(HCl)кон. = 205,3 г ∙ 0,1593 = 32,7 г
n(HCl)кон.= 32,7 г / 36,5 г/моль = 0,896 моль(0,9 моль)
- Вычислим количество вещества соляной кислоты, пошедшей на реакцию с AgNО3:
n(HCl)реакц = 1,1 моль – 0,896 моль = 0,204 моль(0,2 моль)
- Найдем количество вещества и массу неразложившегося нитрата серебра:
По уравнению (2) n(AgNО3)ocт.= n(HCl)реакц.= 0,204 моль. (0,2 моль)
m(AgNО3)ocт.= (AgNО3)ocт.∙ M(AgNО3) = 0,204 моль∙ 170 г/моль = 34,68г.(34 г)
- Найдем массу образовавшегося серебра:
m(Ag) = mостатка – m((AgNО3)ocт) = 88 г – 34,68 г = 53,32 г.(54 г)
n(Ag) = m(Ag)/ M(Ag) = 53,32 г / 108 г/моль = 0,494 моль. (0,5 моль)
- Найдем количество вещества и объем смеси газов, образовавшихся при разложении нитрата серебра:
- По уравнению (1) n(NО2 + O2) =3/2∙n(Ag) = 3/2 ∙0,494моль= 0,741моль(0,75 моль)
V(NO2 + O2) = n(NO2 + O2) ∙Vm= 0,741моль∙ 22,4 л/моль = 16,6л.(16,8л).
Ответ: V(NO2 + O2) = 16,6л. (16,8л).
Реальный ЕГЭ по химии 2018. Задание 34. Вариант 4. При разложении образца карбоната бария выделился газ объемом 4,48 л (в пересчете на н. у.). Масса твердого остатка составила 50 г. После этого к остатку последовательно добавили 100 мл воды и 200 г 20%-ного раствора сульфата натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе.
Решение.
- Запишем уравнение термического разложения карбоната бария:
ВаСО3→ ВаО + СО2(1)
- Таким образом, твердый остаток – это смесь образовавшегося оксида бария и неразложившегося карбоната бария.
- При добавлении воды, оксид бария растворяется:
ВаО + Н2О → Ва(ОН)2(2)
и образовавшийся гидроксид бария взаимодействует далее с сульфатом натрия:
Ва(ОН)2+ Na2SO4 → ВаSO4↓ + 2NaOH(3)
- Карбонат бария нерастворим в воде, поэтому в раствор не переходит.
- Вычислим количество углекислого газа, выделившегося при прокаливании карбоната бария:
n(СO2) = 4,48 л / 22,4 л/моль = 0,2 моль,
Из уравнения (1): n(BaО) = n(CO2) = 0,2 моль,
m(ВаО) = n(ВаО)∙M(ВаО) = 0,2 моль ∙ 153 г/моль = 30,6 г.
- Определим, какой из реагентов Ва(ОН)2 или Na2SO4 вступает в реакцию полностью.
- Вычислим массу и количество вещества сульфата натрия:
m(Na2SO4)в—ва = m(Na2SO4)р—ра∙ ω(Na2SO4) = 200 г ∙ 0,2 = 40 г
n(Na2SO4) = m(Na2SO4)в—ва/ M(Na2SO4) = 40г / 142г/моль= 0,282моль.
- Из уравнения(2): n(BaО) = n(Ва(ОН)2) = 0,2 моль.
- Значит, сульфат натрия взят в избытке, а гидроксид бария реагирует полностью.
- Вычислим количество вещества и массу образовавшегося гидроксида натрия:
Из уравнения (3): n(NaOH) = 2∙n(Ва(ОН)2) = 2∙0,2 моль = 0,4 моль
m(NaOH)в-ва = n(NaOH) ∙ M(NaOH) = 0,4 моль ∙ 40 г/моль = 16 г.
- Вычислим массу образовавшегося раствора:
mкон.р-ра = m(ВаО) + m(Н2O) +m(Na2SO4)р-ра – m(ВаSO4)
m(Н2O) = ρ(Н2O) ∙V(Н2O) = 1 г/мл∙ 100 мл = 100 г
Из уравнения (3): n(ВаSO4) = n(Ва(ОН)2) = 0,2 моль
m(ВаSO4) = n(ВаSO4) ∙ M(ВаSO4) = 0,2 г/моль ∙ 233 моль = 46,6 г.
mкон.р-ра = m(ВаО) + m(Н2O) +m(Na2SO4)р-ра – m(ВаSO4) = 30,6 г + 100 г + 200 г – 46,6 г = 284г.
- Массовая доля гидроксида натрия в растворе равна:
ω(NaOH) = m(NaOH) / mкон.р-ра = 16 г /284 г = 0,0563 (5,63 %).
Ответ: ω(NaOH) = 5,63 %.
Реальный ЕГЭ по химии 2018. Задание 34. Вариант 5. При нагревании образца нитрата магния часть вещества разложилась. Масса твердого остатка составила 15,4 г. Этот остаток может прореагировать с 20 г 20%-ного раствора гидроксида натрия. Определите массу исходного образца и объем выделившихся газов (в пересчете на н. у.).
Решение.
- Запишем уравнение термического разложения нитрата магния:
2Mg(NO3)2→t 2MgО + 4NO2 + O2 + {Mg(NO3)2}ост. (1),
где {Cu(NO3)2}ост. – неразложившаяся часть нитрата магния.
- Таким образом, твердый остаток – это смесь образовавшегося оксида магния и оставшегося нитрата магния. С гидроксидом натрия реагирует только один компонент твердого остатка – оставшийсяMg(NO3)2:
Mg(NO3)2 + 2NaOH → Mg(OH)2 + 2NaNO3 (2)
- Найдем количество вещества и массу гидроксида натрия:
m(NaOH) = m(NaOH)р-ра ∙ ω(NaOH) = 20 г ∙ 0,2 = 4 г
n(NaOH). = m(NaOH)/ М(NaOH) = 4 г / 40 г/моль = 0,1 моль.
Из уравнения(2): n(Mg(NO3)2)ост. = 0,5∙n(NaOH) = 0,5∙0,1 моль = 0,05 моль,
m(Mg(NO3)2)ост. = n(Mg(NO3)2)ост. ∙ M(Mg(NO3)2) = 0,05моль,∙ 148г/моль = 7,4г.
- Найдем массу и количество вещества оксида магния:
m(MgО) = mостатка – m(Mg(NO3)2)ост. = 15,4г – 7,4г = 8г.
n(MgО). = m(MgО)/ М(MgО) = 8г / 40 г/моль = 0,2моль.
- Найдем количество вещества и объем газовой смеси:
Из уравнения (1): n(NO2 + O2) = 5/2 ∙n(CuО)= 5/2 ∙ 0,2моль= 0,5 моль.
V(NO2 + O2) = n(NO2 + O2) ∙Vm= 0,5 моль∙ 22,4 л/моль = 11,2 л.
- Найдем количество вещества и массу исходного карбоната магния:
Изуравнения(1): n(Mg(NO3)2)реакц. = n(MgО) = 0,2 моль.
m(Mg(NO3)2)реакц. = n(Mg(NO3)2)реакц. ∙ M(Mg(NO3)2) = 0,2 моль,∙ 148 г/моль = 29,6г.
m(Mg(NO3)2)исх. = m(Mg(NO3)2)реакц. +m(Mg(NO3)2)ост = 29,6 г+7,4г = 37г.
Ответ:V(NO2 + O2) = 11,2 л; m(Mg(NO3)2) = 37 г.
Реальный ЕГЭ по химии 2018. Задание 34. Вариант 6. При разложении образца карбоната бария выделился газ объемом 1,12 л (в пересчете на н. у.). Масса твердого остатка составила 27,35 г. После этого к остатку добавили 73 г 30%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в образовавшемся растворе.
Решение:
- При разложении карбоната бария образуется оксид бария и выделяется углекислый газ:
ВаСО3→t ВаО + СО2
- Вычислим количество углекислого газа, выделившегося при прокаливаниикарбоната бария:
n(СO2) = 1,12 л / 22,4 л/моль = 0,05 моль,
следовательно, в результате реакции разложения карбоната бария образовалось 0,05 моль оксида бария и прореагировало также 0,05 моль карбоната бария. Вычислим массу образовавшегося оксида бария:
m(ВаО) = 153 г/моль ∙ 0,05 моль = 7,65 г.
- Вычислим массу и количество вещества оставшегося карбоната бария:
m(ВаСО3)ост. = 27,35 г – 7,65 г = 19,7 г
n(ВаСО3)ост.= 19,7 г / 197 г/моль = 0,1 моль.
- С соляной кислотой взаимодействуют оба компонента твердого остатка – образовавшийся оксид бария и оставшийся карбонат бария:
ВаО + 2НСl → ВаСl2 + Н2O
ВаСО3 + 2НСl → ВаСl2 + CO2↑ + Н2O.
- Вычислим количество вещества и массу хлороводорода, взаимодействующего с оксидом и карбонатом бария:
n(НCl) = (0,05 моль + 0,1 моль) ∙ 2 = 0,3 моль;
m(НСl) = 36,5 г/моль ∙ 0,3 моль = 10,95 г.
- Вычислим массу оставшегося хлороводорода:
m(НСl)ост. = 73 г ∙ 0,3 – 10,95 г = 10,95 г.
- Вычислим массуконечного раствора:
mкон.р-ра= mостатка + m(НCl)р-ра –m(СО2) =27,35 г +73г– 4,4 г= 95,95 г.
- Массовая доля оставшейся соляной кислоты в растворе равна:
ω(HCl) = m(HCl)ост. / mкон.р-ра = 10,95 г / 95,95 г = 0,114 (11,4 %).
Ответ: ω(HCl) = 11,4 %.
Реальный ЕГЭ по химии 2018. Задание 34. Вариант 7. При нагреванииобразца нитрата серебра часть вещества разложилась и выделилась смесь газов объемом 6,72 л (в пересчете на н. у.). Масса остатка составила 25 г. После этого остаток поместили в 50 мл воды и добавили 18,25 г 20%-ного раствора соляной кислоты. Определите массовую долю соляной кислоты в полученном растворе.
Решение.
- Запишем уравнение термического разложения нитрата серебра (I):
2AgNО3→ 2Ag + 2NО2 + O2 (1)
- Твердый остаток – это смесь образовавшегося серебра и оставшегося нитрата серебра (I).
- С соляной кислотой реагирует только нитрат серебра (I):
AgNО3+ HCl → AgCl↓ + HNO3 (2)
- Вычислим количество газов, образующихся при разложении нитрата серебра:
n(NО2 + O2) = 6,72 л/22,4 л/моль = 0,3 моль.
- По уравнению (1) n(Ag) = 2/3∙n(NО2 + O2) = 2/3∙0,3 моль = 0,2 моль
m(AgNО3)ocт. = 25 г – 21,6 г = 3,4 г
n(AgNО3)ocт. = 3,4 г / 170 г/моль = 0,02 моль.
- Вычислим массу и количество вещества соляной кислоты в ее исходном растворе:
m(HCl)иcx.= 18,25 г∙ 0,2 = 3,65 г
n(HCl)иcx.= 3,65 г/36,5 г/моль = 0,1 моль
- По уравнению (2) n(AgNО3)ocт.= n(AgCl) = n(HCl)реакц., где n(HCl)реакц. – количество вещества соляной кислоты, пошедшей на реакцию с AgNО3. Следовательно, количество вещества и масса непрореагировавшей соляной кислоты:
n(НCl)ост.= 0,1 моль – 0,02 моль = 0,08 моль;
m(НСl)ост. = 0,08 моль∙ 36.5 г/моль = 2,92 г.
- Вычислим массу выпавшего осадка
m(AgCl) = n(AgCl) ∙M(AgCl) = 0,02 моль∙ 143,5 г/моль = 2,87 г.
- Масса получившегося раствора равна:
mкон.p-pa = mостатка + m(НCl)р-ра + m(Н2О) – m(AgCl) = 3,4 г + 18,25 г + 50 г – 2,87 г = 68,78 г.
- Массовая доля в получившемся растворе соляной кислоты равна:
ω(НСl) = m(НСl)ост./ mкон.p-pa = 2,92 г/68,78 г = 0,0425 (4,25 %).
Ответ: ω(НСl) = 4,25 %.
Реальный ЕГЭ по химии 2018. Задание 34. Вариант 8. При нагревании образца нитрата цинка часть вещества разложилась, при этом выделилось 5,6 л газов (в пересчете на н. у.). Остаток массой 64,8 г полностью растворили в минимальном объеме 28%-ного раствора гидроксида натрия. Определите массовую долю нитрата натрия в конечном растворе.
Решение.
- Запишем уравнение термического разложения нитрата цинка:
2Zn(NO3)2→ 2ZnО + 4NO2 + O2 + {Zn(NO3)2}ост. (1),
где {Zn(NO3)2}ост. – неразложившаяся часть нитрата цинка.
- Таким образом, твердый остаток – это смесь образовавшегося оксида цинка и оставшегося нитрата цинка.
- С раствором гидроксида натрия реагируют оба компонента твердого остатка – образовавшийся CuО и оставшийся Zn(NO3)2:
ZnО + 2NaOH+ H2O → Na2[Zn(OH)4] (2)
Zn(NO3)2+ 4NaOH→ Na2[Zn(OH)4] + 2NaNO3(3)
- Рассчитаем количество вещества образовавшейся газовой смеси:
n(NO2 + O2) = 5,6 л / 22,4 л/моль = 0,25 моль.
- Из уравнения (1): n(ZnО) = n(NO2 + O2) ∙ 2/5= 0,25 моль ∙ 2/5 = 0,1моль.
m(ZnО) = n(ZnО)∙M(ZnО) = 0,1 моль ∙ 81 г/ моль = 8,1 г.
- Найдем массу оставшегося нитрата цинка и его количество:
m(Zn(NO3)2(ост.)) = mостатка – m(ZnO) = 64,8 г – 8,1 г = 56,7 г.
n(Zn(NO3)2(ост.)) = m(Zn(NO3)2(ост.))/ M(Zn(NO3)2) = 56,7 г / 189 г/моль = 0,3 моль.
- По уравнению (2) рассчитаем количество вещества NaOH, потребовавшегося для реакции с ZnО:
n(NaOH(реакц.)2) = 2∙n(ZnО) = 2∙0,1моль = 0,2моль.
- По уравнению (3) рассчитаем количество вещества NaOH, потребовавшегося для реакции с неразложившимся Zn(NO3)2:
n(NaOH(реакц.)3) = 4∙n(Zn(NO3)2(ост.))= 4∙ 0,3 моль = 1,6 моль.
- Найдем общееколичество вещества и массу гидроксида натрия, потребовавшегося для растворения твердого остатка:
n(NaOH(реакц.)) = n(NaOH(реакц.)2) + n(NaOH(реакц.)3) = 0,2 моль +1,6 моль= 1,8моль
m(NaOH(реакц.))в-ва = n(NaOH(реакц.)) ∙ M(NaOH) = 1,4 моль ∙40 г/моль = 56 г
- Масса 28%-ного раствора гидроксида натрия:
m(NaOH)р-ра = m(NaOH(реакц.))в-ва / ω(NaOH) = 56 г / 0,28 = 200 г
- Найдем количество вещества и массу нитрата натрия в полученном растворе:
n(NaNO3) = 2n(Zn(NO3)2(ост.)) = 2∙0,3 моль = 0,6 моль.
m(NaNO3) = n(NaNO3)∙M(NaNO3) = 0,6 моль∙ 85 г/ моль = 51 г.
- Найдем массу конечного раствора mкон.р-ра:
mкон.р-ра = mостатка + m(NaOH)р-ра= 64,8г + 200г = 264,8г
- Определиммассовую долю нитрата натрия в полученном растворе:
ω(NaNO3) = m(NaNO3)/mкон.р-ра = 51г / 264,8г = 0,1926 (19,26 %)
Ответ:ω(NaNO3) = 19,26 %
Реальный ЕГЭ по химии 2018. Задание 34. Вариант 10. При проведении электролиза 500 г 16 % раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20 %-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Решение.
- Запишем уравнение электролиза водного раствора сульфата меди (II):
2CuSO4 + 2H2O→(электролиз)2Сu + O2 + 2H2SO4
- Найдем массу и количество вещества исходного сульфата меди (II):
m(CuSO4)исх. = m(CuSO4)р-ра∙ω(CuSO4) = 500 г ∙ 0,16 = 80 г
n(CuSO4)исх. = m(CuSO4)исх./М(CuSO4) = 80 г / 160 г/моль = 0,5 моль.
- Найдем количество вещества выделившегося на аноде кислорода:
n(О2)= V(О2)/Vm= 1,12 л / 22,4 л/моль = 0,05 моль.
- Найдем количество вещества и массу CuSO4, оставшегосяв растворе:
n(CuSO4)реакц. = 2∙n(О2) = 2∙0,05 моль = 0,1 моль.
n(CuSO4)ост. = n(CuSO4)исх. – n(CuSO4)реакц. = 0,5 моль – 0,1 моль = 0,4 моль.
m(CuSO4)ост. =n(CuSO4)ост.∙ М(CuSO4) = 0,4 моль ∙ 160 г/моль = 64 г.
- Найдем массу конечного раствора:
mкон.р-ра = m(CuSO4)р-ра – m(O2) – m(Cu)
m(О2) = n(О2)∙М(О2) = 0,05 моль ∙ 32 г/моль = 1,6 г.
n(Cu) = n(CuSO4)реакц.= 0,1 моль.
m(Cu) = n(Cu)∙М(Cu) = 0,1 моль ∙ 64 г/моль = 6,4 г.
mкон.р-ра = m(CuSO4)р-ра – m(O2) – m(Cu) = 500 г – 1,6 г – 6,4 г = 492 г
n(H2SO4) = n(CuSO4)реакц. = 0,1 моль.
m(H2SO4)=n(H2SO4)∙ М(H2SO4) = 0,1 моль∙ 98 г/моль = 9,8 г.
ω(CuSO4)кон.= m(CuSO4)ост./mкон.р—ра = 64 г / 492 г = 0,13
ω(H2SO4)кон. = m(H2SO4)/mкон.р-ра = 9,8г / 492 г = 0,02
- Найдем массу и количество вещества сульфата меди (II) в отобранной порции:
m(CuSO4)порц. = mпорц р-ра.∙ ω(CuSO4)кон. = 98,4 г ∙ 0,13 = 12,8 г
n(CuSO4)порц. = m(CuSO4)порц. / М(CuSO4) = 12,8 г / 160 г/моль = 0,08 моль.
- Найдем массу и количество вещества гидроксида бария в отобранной порции:
m(H2SO4)порц. = mпорц р-ра.∙ ω(H2SO4)кон. = 98,4 г ∙ 0,02 = 1,968 г
n(H2SO4)порц. = m(H2SO4)порц. / М(H2SO4) = 1,968г / 98г/моль = 0,02моль.
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4(1)
H2SO4+ 2NaOH→Na2SO4 + 2H2O (2)
- Найдем массу гидроксида натрия, потребовавшегося для осаждения ионов Cu2+:
Из уравнения (1): n(NaOH)1 = 2∙n(CuSO4)порц.= 2∙0,08 моль = 0,16 моль.
Из уравнения (2):n(NaOH)2= 2∙n(H2SO4)порц. = 2∙ 0,02моль = 0,04моль.
n(NaOH(реакц.)) = n(NaOH(реакц.)1) + n(NaOH(реакц.)2) = 0,16моль +0,04моль= 0,2моль
m(NaOH)в-ва = n(NaOH)∙М(NaOH) = 0,2моль∙ 40 г/моль= 8г .
m(NaOH)р-ра = m(NaOH)в-ва / ω(NaOH) = 8г / 0,2 = 40г.
Ответ:m(NaOH)р-ра = 40г.
Реальный ЕГЭ по химии 2018. Задание 34. Вариант 11. Электролиз 282 г 40 % раствора нитрата меди (II) остановили после того, когда, масса раствора уменьшилась на 32 г. К образовавшемуся раствору добавили 140 г 40%-ого раствора гидроксида натрия. Определите массовую долю щелочи в полученном растворе.
Решение.
- Запишем уравнение электролиза водного раствора нитрата меди (II):
2Cu(NO3)2 + 2H2O→(электролиз)2Сu + O2 + 4HNO3
- Уменьшение массы раствора произошло за счет выделения меди на катоде и кислорода на аноде.
Проверим, остался ли в растворе нитрат меди (II) после окончания электролиза (когда Cu(NO3)2полностьюпрореагирует, начнется электролиз воды).
- Найдем массу и количество вещества исходного сульфата меди (II):
m(Cu(NO3)2)исх. = m(Cu(NO3)2)р—ра∙ ω(Cu(NO3)2) = 282 г ∙ 0,4 = 112,8г
n(Cu(NO3)2)исх. = m(Cu(NO3)2)исх. / М(Cu(NO3)2) = 112,8г / 189г/моль = 0,6 моль.
Если весь Cu(NO3)2будет израсходован, то согласно уравнению электролиза масса образовавшейся меди составит 0,6 моль ∙ 64 г/моль = 38,4 г, что уже превосходит сумму масс меди и кислорода (32 г), выделившихся из раствора. Следовательно, после электролиза в растворе остался Cu(NO3)2.
- Добавленный гидроксид натрия реагирует с оставшимся Cu(NO3)2и образовавшейся азотной кислотой:
Cu(NO3)2+ 2NaOH → Cu(OH)2↓+ 2NaNO3(1)
HNO3+ NaOH → Na2SO4 + Н2О (2)
- Пусть количество вещества образовавшегося кислорода n(O2) = хмоль. Тогда количество вещества образовавшейся меди n(Сu) = 2xмоль. m(O2) = 32x(г), аm(O2) = 64∙2x = 128x(г). По условию задачи: m(O2) + m(O2) = 32.
32x + 128x = 32
х = 0,2(моль)
- Найдем количество вещества нитрата меди (II), подвергшегося электролизу:
n(Cu(NO3)2)реакц. = n(Cu) = 2xмоль = 2∙0,2 моль = 0,4 моль.
- Найдем количество вещества нитрата меди (II), оставшегося в растворе:
n(Cu(NO3)2)ост.= n(Cu(NO3)2)исх. – n(Cu(NO3)2)реакц.= 0,6 моль – 0,4 моль = 0,2 моль.
- Найдем количество вещества образовавшейся азотной кислоты:
n(HNO3) = 2∙n(CuSO4)реакц.= 2∙0,4 моль = 0,8 моль
- Определим массу и количество вещества исходного раствора гидроксида натрия:
m(NaOH(исх.))в-ва = m(NaOH(исх.))р-ра ∙ ω(NaOH) = 140г ∙ 0,4 = 56г
n(NaOH(исх.)) = m(NaOH(исх.))в-ва / M(NaOH) = 56г / 40 г/моль = 1,4моль.
- Определим количество вещества и массу гидроксида натрия, оставшегося в растворе:
n(NaOH)реакц.1 = 2∙n(CuSO4)ост. = 2∙0,2 моль = 0,4 моль.
n(NaOH)реакц.2 = n(HNO3) = 0,8 моль.
n(NaOH)ост. = n(NaOH)исх.–n(NaOH)реакц.1–n(NaOH)реакц.2 = 1,4моль–0,4 моль–0,8моль=0,2моль.
m(NaOH)ост. =n(NaOH)ост.∙ М(NaOH) = 0,2моль ∙ 40 г/моль = 8г.
- Найдем массу образовавшегося раствора и массовую долю гидроксида натрия в нем:
mкон.р-ра = m(Cu(NO3)2)р-ра + m(NaOH(исх.))р-ра – (m(Cu) + m(O2)) – m(Cu(OH)2)=
= 282г + 140 г – 32 г – (0,2 моль ∙ 98 г/моль) = 370,4г
ω(NaOH)кон.р-р = m(NaOH)ост./mкон.р-ра = 8г / 370,4 г = 0,216 (2,16 %).
Ответ: ω(NaOH) = 2,16 %.
Реальный ЕГЭ по химии 2018. Задание 34. Вариант 12. При проведении электролиза 340 г 20 %-ного раствора нитрата серебра (I) процесс прекратили, когда на аноде выделилось 1,12 л газа. Из полученного раствора отобрали порцию массой 79,44 г. Вычислите массу 10 %-ного раствора хлорида натрия, необходимого для полного осаждения ионов серебра из отобранной порции раствора.
Решение.
- Запишем уравнение электролиза водного раствора нитрата серебра (I):
4AgNO3 + 2H2O→(электролиз)4Ag + O2 + 4HNO3
- Найдем массу и количество вещества исходного нитрата серебра (I):
m(AgNO3)исх. = m(AgNO3)р-ра∙ ω(AgNO3) = 340 г ∙ 0,2 =68г
n(AgNO3)исх. = m(AgNO3)исх. / М(AgNO3) = 68г / 170 г/моль = 0,4моль.
- Найдем количество вещества выделившегося на аноде кислорода:
n(О2)= V(О2)/Vm= 1,12 л / 22,4 л/моль = 0,05 моль.
- Найдем количество вещества и массу AgNO3, оставшегося в растворе:
n(AgNO3)реакц. = 4∙n(О2) = 4∙0,05 моль = 0,2моль.
n(CuSO4)ост. = n(AgNO3)исх. – n(AgNO3)реакц. = 0,4моль – 0,2моль = 0,2моль.
m(AgNO3)ост. =n(AgNO3)ост.∙ М(AgNO3) = 0,2моль ∙ 170 г/моль = 34г.
- Найдем массу конечного раствора:
mкон.р-ра = m(AgNO3)р-ра – m(O2) – m(Ag)
m(О2) = n(О2)∙М(О2) = 0,05 моль ∙ 32 г/моль = 1,6 г.
n(Ag) = n(AgNO3)реакц.= 0,2моль.
m(Ag) = n(Ag)∙М(Ag) = 0,2моль ∙108г/моль = 21,6г.
mкон.р-ра = m(AgNO3)р-ра – m(O2) – m(Ag) = 340г – 1,6 г – 21,6г = 316,8г
ω(AgNO3)кон. = m(AgNO3)ост./mкон.р-ра = 34г / 316,8г = 0,107.
- Найдем массу и количество вещества нитрата серебра (I) в отобранной порции:
m(AgNO3)порц. = mпорц р-ра.∙ ω(AgNO3)кон. = 79,44 г ∙ 0,107 = 8,5г.
n(AgNO3)порц. = m(AgNO3)порц. / М(AgNO3) = 8,5г / 170 г/моль = 0,05моль.
AgNO3+ NaCl → AgCl +NaNO3
n(NaCl) = n(AgNO3)порц.= 0,05моль.
m(NaCl)в-ва = n(NaCl) ∙ М(NaCl) = 0,05моль∙ 58,5г/моль= 2,925г .
m(NaCl)р-ра = m(NaCl)в-ва / ω(NaCl) = 40,2г / 0,1 = 29,25г.
Ответ:m(NaCl)р-ра= 29,25г.
Реальный ЕГЭ по химии 2018. Задание 34. Вариант 13. При проведении электролиза 312 г 15 %-ного раствора хлорида натрия процесс прекратили, когда на катоде выделилось 6,72 л газа. Из полученного раствора отобрали порцию массой 58,02 г. Вычислите массу 20 %-ного раствора сульфата меди (II), необходимого для полного осаждения гидроксил-ионов из отобранной порции раствора.
Решение.
- Запишем уравнение электролиза водного раствора хлорида натрия:
2NaCl + 2H2O→(электролиз)H2 + Cl2 + 2NaOH
- Найдем массу и количество вещества исходного хлорида натрия:
m(NaCl)исх. = m(NaCl)р-ра∙ ω(NaCl) = 312 г ∙ 0,15 = 46,8г
n(NaCl)исх. = m(NaCl)исх. / М(NaCl) = 46,8г / 58,5г/моль = 0,8моль.
- Найдем количествовещества выделившегося на катоде водорода:
n(H2)= V(H2)/Vm= 6,72л / 22,4 л/моль = 0,3моль.
- Найдем количество вещества и массу образовавшегося NaOH:
n(NaOH) = 2∙n(H2) = 2∙ 0,3моль = 0,6моль.
m(NaOH) = n(NaOH)∙М(NaOH) = 0,6моль ∙ 40г/моль = 24г.
- Найдем массу конечного раствора:
mкон.р-ра = m(NaCl)р-ра – m(H2)–m(Cl2)
m(H2) = n(H2)∙М(H2) = 0,3моль ∙ 2г/моль = 0,6г.
n(Cl2) = n(H2) = 0,3моль.
m(Cl2) = n(Cl2)∙М(Cl2) = 0,3моль ∙ 71г/моль = 21,3г.
mкон.р-ра = m(NaCl)р-ра – m(H2) – m(Cl2) = 312г – 0,6 г – 21,3г = 290,1г
ω(NaOH)кон. = m(NaOH)/mкон.р-ра = 24г / 290,1г = 0,0827
- Найдем массу и количество вещества гидроксида натрия в отобранной порции:
m(NaOH)порц. = mпорц р-ра.∙ ω(NaOH)кон. = 58,02 г ∙ 0,0827 = 4,8 г
n(NaOH)порц. = m(NaOH)порц. / М(NaOH) = 4,8г / 40= 0,12моль.
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
n(CuSO4) = 0,5∙n(NaOH)порц. = 0,5 ∙ 0,12 моль = 0,06моль
m(CuSO4)в—ва = n(CuSO4) ∙ М(CuSO4) = 0,06моль∙ 160 г/моль= 9,6 г .
m(CuSO4)р-ра = m(CuSO4)в-ва / ω(CuSO4) = 9,6г / 0,2 = 48 г.
Ответ:m(CuSO4)р-ра= 48 г.
Реальный ЕГЭ по химии 2018. Задание 34. Вариант 15. При проведении электролиза 360 г 18,75 % раствора хлорида меди (II) процесс прекратили, когда на аноде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 22,2 г. Вычислите массу 20 %-ного раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора.
Решение.
- Запишем уравнение электролиза водного раствора хлорида меди (II):
CuCl2→(электролиз)Сu + Cl2
- Найдем массу и количество вещества исходного хлорида меди (II):
m(CuCl2)исх. = m(CuCl2)р-ра ∙ ω(CuCl2) = 360 г ∙ 0,1875 = 67,5г.
n(CuCl2)исх. = m(CuCl2)исх./М(CuCl2) = 67,5г / 135 г/моль = 0,5моль.
- Найдем количество вещества выделившегося на аноде хлора:
n(Cl2)= V(Cl2)/Vm= 4,48 л / 22,4 л/моль = 0,2 моль.
- Найдем количество вещества и массу CuCl2, оставшегося, в растворе:
n(CuCl2)реакц. = n(Cl2) = 0,2 моль.
n(CuCl2)ост. = n(CuCl2)исх. – n(CuCl2)реакц. = 0,5моль – 0,2 моль = 0,3моль.
m(CuCl2)ост. =n(CuCl2)ост. ∙ М(CuCl2) = 0,3моль∙135 г/моль = 40,5г.
- Найдем массу конечного раствора:
mкон.р-ра = m(CuCl2)р-ра – m(Cl2) – m(Cu)
m(Cl2) = n(Cl2) ∙ М(Cl2) = 0,2 моль ∙ 71 г/моль = 14,2 г.
n(Cu) = n(Cl2) = 0,2 моль.
m(Cu) = n(Cu) ∙ М(Cu) = 0,2 моль ∙ 64 г/моль = 12,8 г.
mкон.р-ра = m(CuCl2)р-ра – m(Cl2) – m(Cu) = 360 г – 14,2 г – 12,8 г = 333 г
ω(CuCl2)кон. = m(CuCl2)ост. / mкон.р-ра = 40,5г / 333 г = 0,122.
- Найдем массу и количество вещества хлорида меди (II) в отобранной порции:
m(CuCl2)порц. = mпорц р-ра.∙ ω(CuCl2)кон. = 22,2 г∙ 0,122 = 2,71г.
n(CuCl2)порц. = m(CuCl2)порц. / М(CuCl2) = 2,71г / 135 г/моль = 0,02моль.
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
- Найдем массу раствора гидроксида натрия, необходимого для осаждения Cu2+:
n(NaOH) = 2∙n(CuCl2)порц. = 2 ∙ 0,02моль = 0,04моль.
m(NaOH)в-ва = n(NaOH) ∙ М(NaOH) = 0,04моль ∙ 40 г/моль = 1,6г.
m(NaOH)р-ра = m(NaOH)в-ва / ω(NaOH) = 1,6г/ 0,2 = 8г.
Ответ:m(NaOH)р-ра = 8г.
Реальный ЕГЭ по химии 2018. Задание 34. Вариант 16. При проведении электролиза 624 г 10 %-ного раствора хлорида бария процесс прекратили, когда на катоде выделилось 4,48 л газа. Из полученного раствора отобрали порцию массой 91,41 г. Вычислите массу 10 %-ного раствора карбоната натрия, необходимого для полного осаждения ионов бария из отобранной порции раствора.
Решение.
- Запишем уравнение электролиза водного раствора хлорида бария:
ВaCl2 + 2H2O →(электролиз)H2 + Cl2 + Вa(OH)2
- Найдем массу и количество вещества исходного хлорида бария:
m(ВaCl2)исх. = m(ВaCl2)р-ра∙ ω(ВaCl2) = 624 г ∙ 0,1 = 62,4г
n(ВaCl2)исх. = m(ВaCl2)исх. / М(ВaCl2) = 62,4г / 208г/моль = 0,3моль.
- Найдем количествовещества выделившегося на катоде водорода:
n(H2)= V(H2)/Vm= 4,48л / 22,4 л/моль = 0,2моль.
- Найдем количество вещества и массу образовавшегося Вa(OH)2:
n(Вa(OH)2) = n(H2) = 0,2моль.
m(Вa(OH)2) = n(Вa(OH)2)∙М(Вa(OH)2) = 0,2моль ∙ 171г/моль = 34,2г.
- Найдем количество вещества и массу ВaCl2, оставшегося в растворе:
n(ВaCl2)реакц. = n(H2) = 0,2моль.
n(ВaCl2)ост. = n(ВaCl2)исх. – n(ВaCl2)реакц. = 0,3моль – 0,2моль = 0,1моль.
m(ВaCl2)ост. =n(ВaCl2)ост.∙ М(ВaCl2) = 0,1моль ∙ 208г/моль = 20,8г.
- Найдем массу конечного раствора:
mкон.р-ра = m(ВaCl2)р-ра – m(H2)–m(Cl2)
m(H2) = n(H2)∙М(H2) = 0,2моль ∙ 2г/моль = 0,4г.
n(Cl2) = n(H2) = 0,2моль.
m(Cl2) = n(Cl2)∙М(Cl2) = 0,2моль ∙ 71г/моль = 14,2г.
mкон.р-ра = m(ВaCl2)р-ра – m(H2) – m(Cl2) = 624г – 0,4г – 14,2г = 609,4г
ω(ВaCl2)кон. = m(ВaCl2)/mкон.р-ра = 20,8г / 609,4г = 0,0341
ω(Вa(OH)2)кон. = m(Вa(OH)2)/mкон.р-ра = 34,2г / 609,4г = 0,0561
- Найдем массу и количество вещества гидроксида бария в отобранной порции:
m(Вa(OH)2)порц. = mпорц р-ра.∙ ω(Вa(OH)2)кон. = 91,41 г ∙ 0,0561 = 5,13 г
n(Вa(OH)2)порц. = m(Вa(OH)2)порц. / М(Вa(OH)2) = 5,13г / 171г/моль = 0,03моль.
- Найдем массу и количество вещества хлорида бария в отобранной порции:
m(ВaCl2)порц. = mпорц р-ра.∙ ω(ВaCl2)ост. = 91,41 г ∙ 0,0341 = 3,12г
n(ВaCl2)порц. = m(ВaCl2)порц. / М(ВaCl2) = 3,12г / 208 г/моль = 0,015моль.
Вa(OH)2 + Na2CO3 → ВaCO3 + 2NaOH (1)
ВaCl2 + Na2CO3 → ВaCO3 + 2NaCl (2)
- Найдем массу растворакарбоната натрия, необходимого для осаждения ионов Вa2+:
Изуравнения (1): n(Na2CO3)1 = n(Вa(OH)2)порц. = 0,03моль
Изуравнения (2): n(Na2CO3)2 = n(ВaCl2)порц.= 0,015моль
n(Na2CO3)= n(Na2CO3)1 + n(Na2CO3)2 = 0,03 моль + 0,015 моль = 0,045 моль
m(Na2CO3)в—ва = n(Na2CO3)∙ M(Na2CO3) = 0,045 моль∙ 106 г/моль = 4,77 г
m(Na2CO3)р—ра = m(Na2CO3)в—ва/ ω(Na2CO3) = 4,77 г / 0,1 = 47,7 г.
Ответ:m(Na2CO3)р-ра= 47,7 г.
Реальный ЕГЭ по химии 2018. Задание 34. Вариант 17. При проведении электролиза 500 г 16 %-ного раствора сульфата меди (II) процесс прекратили, когда на аноде выделилось 1,12 л газа. К образовавшемуся раствору прибавили 53 г 10 %-ного раствора карбоната натрия. Определитемассовую долю сульфата меди (II) в полученном растворе.
Решение.
- Запишем уравнение электролиза водного раствора сульфата меди (II):
2CuSO4 + 2H2O→(электролиз)2Сu + O2 + 2H2SO4
- Найдем массу и количество вещества исходного сульфата меди (II):
m(CuSO4)исх. = m(CuSO4)р-ра∙ ω(CuSO4) = 500 г ∙ 0,16 = 80 г
n(CuSO4)исх. = m(CuSO4)исх. / М(CuSO4) = 80 г / 160 г/моль = 0,5 моль.
- Найдем количество вещества выделившегося на аноде кислорода:
n(О2)= V(О2)/Vm= 1,12 л / 22,4 л/моль = 0,05 моль.
- Найдем количество вещества и массуCuSO4, оставшегосяв растворе после электролиза:
n(CuSO4)реакц. = 2∙n(О2) = 2∙0,05 моль = 0,1 моль.
n(CuSO4)ост. = n(CuSO4)исх. – n(CuSO4)реакц. = 0,5 моль – 0,1 моль = 0,4 моль.
m(CuSO4)ост. =n(CuSO4)ост.∙ М(CuSO4) = 0,4моль ∙ 160г/моль = 64г.
- Найдем количество вещества образовавшейся серной кислоты:
n(Н2SO4) = n(CuSO4)реакц.= 0,1моль.
- Найдем массу и количество вещества добавленного карбоната натрия:
m(Nа2СО3) = m(Nа2СО3)р-ра∙ ω(Nа2СО3) = 53 г ∙ 0,1 = 5,3г
n(Nа2СО3) = m(Nа2СО3)/ М(Nа2СО3) = 5,3г / 106г/моль = 0,05моль.
- При добавлении карбоната натрия возможно одновременное протекание реакций:
2CuSO4 + 2Nа2СО3 + Н2O → (СuОН)2СО3↓ + СО2↑ + 2Na2SO4(1)
Н2SO4 + Na2CO3 → СО2↑ + Н2О + Na2SO4 (2)
Т.к. серная кислота в избытке, то она сразу же растворяет образующийся по реакции (1) основный карбонат меди с образованием CuSO4 и выделением CO2:
(СuОН)2СО3+ 2Н2SO4→2CuSO4+ СО2↑ + 3Н2О (3)
Таким образом, количество CuSO4в растворе остается неизменным, а общее количество выделившегося CO2в реакциях (2) и (3) определяется количеством карбоната натрия:
n(Na2CO3) = n(СО2) = 0,05 моль
- Найдем массу конечного раствора:
mкон.р-ра = m(CuSO4)р-ра – m(Сu)–m(О2) + m(Nа2СО3) – m(СО2)
m(О2) = n(О2) ∙ М(О2) = 0,05моль ∙ 32г/моль = 1,6г.
n(Cu) = 2∙n(О2) = 2 ∙ 0,05моль = 0,1 моль.
m(Cu) = n(Cu) ∙ М(Cu) = 0,1моль ∙ 64 г/моль = 6,4г.
m(СО2) = n(СО2)∙М(СО2) = 0,05 моль ∙ 44 г/моль= 2,2 г.
mкон.р-ра = m(CuSO4)р-ра – m(Сu)–m(О2) + m(Nа2СО3) – m(СО2) =
= 500 г – 6,4г – 1,6г + 53 г – 2,2 г = 542,8 г.
- Найдем массовую долю сульфата меди (II) в полученном растворе:
ω(CuSO4)кон.р-р = m(CuSO4)ост./mкон.р-ра = 64г / 542,8 г = 0,118 (11,8 %).
Ответ: ω(CuSO4) = 11,8 %.
Решение
Общая формула вещества CxHy.
Запишем уравнение реакции:
CxHy+ (x+y/4)О2 = хСО2 + (y/2)Н2О
Определим количество вещества углерода и водорода:
n(C) =n(CO2) = 8,96/22,4 = 0,4 моль
n(Н) =n(H2O)*2 = (4,5/18)*2 = 0,5 моль
Таким образом соотношение количеств вещества углерода и водорода в исходном органическом веществе составляет примерно4:5.
Возможные варианты включают С4Н5, С8Н10, С12Н15, С16Н20.
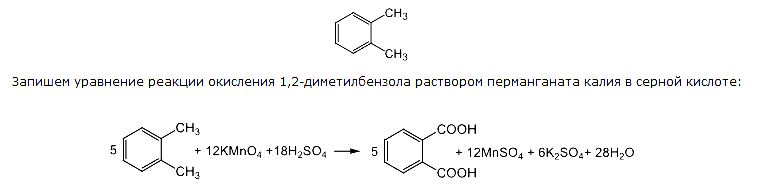
Исходя из общих формул различных классов органических соединений получаем, что искомое вещество С8Н10 (СnH2n-6) – 1,2-диметилбензол, так как только он в реакции с перманганатом калия в кислой среде образует двухосновную карбоновую кислоту, в которой карбоксильные группы находятся в соседних положениях
Реальный ЕГЭ по химии 2018. Задание 35. Вариант 2. При сгорании 21,6 г органического соединения образовалось 31,36 л СО2 и 14,4 г Н2О. Вещество вступает в реакцию этерификации с уксусной кислотой. Определите молекулярную и структурную формулу вещества.
Решение
В реакцию этерификации с карбоновыми кислотами вступают спирты.
Общая формула вещества CxHyOz
Найдем соотношение углерода и водорода:
n(C) = n(CO2) = 31,36/22,4 = 1,4 моль
n(Н) = n(H2O)*2 = (14,4/18)*2 = 1,6 моль
Соотношение углерода к водороду 7 к 8.
Такое возможно в соединении С7H8O. Проверим по массе, данной в условии задачи.
n(С7H8O) = 1,4/7 = 0,2 моль.
М(С7H8O) = 21,6/0,2 = 108
М(С7H8O) = 7*12 + 8*1 + 16 = 108.
Учитывая, что фенолы не вступают в реакции этерификации с карбоновыми кислотами, правильный ответ: бензиловый спирт
Реальный ЕГЭ по химии 2018. Задание 35. Вариант 5. При сгорании органического вещества, не содержащего кислород, образуется 19,8 г углекислого газа, 5,4 г воды и 6,72 л НСl. Это вещество можно получить взаимодействием соответствующего углеводорода с избытком НСl. Определите молекулярную и структурную формулу вещества.
Решение
Общая формула вещества CxHyClz
Найдем соотношение углерода, водорода и хлора:
n(C) = n(CO2) = 19,8/44 = 0,45 моль
n(Н) = n(H2O)*2 + n(HCl) = (5,4/18)*2 + 6,72/22,4 = 0,9 моль
n(Cl) = n(HCl) = 6,72/22,4 = 0,3 моль
Соотношение углерода к водороду и к хлору 3:6:2.
Учитывая способ получения вещества: взаимодействие безкислородного углеводорода с избытком НСl, делаем вывод о том, что соединение относится к алкенам, алкинам, аренам или алкадиенам.
Возможный вариант один (исходя из существующих общих формул указанных выше классов безкислородных органических веществ): C3H6Cl2 – 2,2-дихлорпропан
Получить это вещество гидрогалогенированием возможно из пропина
Реальный ЕГЭ по химии 2018. Задание 35. Вариант 6. При сгорании 1,86 грамм вещества, не содержащего кислород образуется 1,26 г воды и 224 мл азота. Это вещество может быть получено из соответствующего нитросоединения. Определите молекулярную и структурную формулу вещества.
Решение
Общая формула вещества (учитывая способ получения по условию задачи): CxHyN
Количество вещества азота и водорода в соединении:
n(N) = 2*n(N) = 2*0,224/22,4 = 0,02 моль
n(Н) = n(H2O)*2 = (1,26/18)*2 = 0,14 моль
Соотношение азота к водороду составляет 1:7
Учитывая. что в молекуле искомого органического вещества содержится 1 атом азота, то количество вещества искомого соединения равно количеству вещества азота и равно 0,02 моль
Найдем молярную массу искомого соединения: М = m/n = 1,86/0,02 = 93
В состав вещества входит 1 атом азота, 7 атомов водорода. Вычтем из 93 относительную атомную массу 1 атома азота и 7 атомов водорода: 93 — 14 — 7 = 72. Атомная масса углерода 12. То есть в молекуле искомого вещества 6 атомов углерода
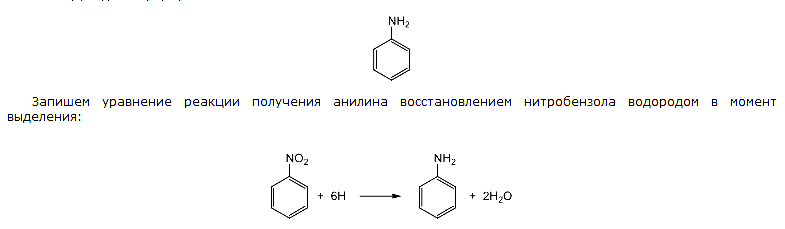
Ответ C6H7N — нитробензол
Реальный ЕГЭ по химии 2018. Задание 35. Вариант 7. При сгорании органического вещества, не содержащего кислород, образуется 5,28 г углекислого газа, 0,72 г воды и 4,48 л НСl. Определите молекулярную и структурную формулу вещества.
Решение
Общая формула вещества CxHyClz
Найдем соотношение углерода, водорода и хлора:
n(C) = n(CO2) = 5,28/44 = 0,12 моль
n(Н) = n(H2O)*2 + n(HCl) = (0,72/18)*2 + 0,448/22,4 = 0,1 моль
n(Cl) = n(HCl) = 0,448/22,4 = 0,02 моль
Соотношение углерода к водороду и к хлору 6:5:1.
Учитывая способ получения вещества: взаимодействие безкислородного углеводорода с избытком НСl, делаем вывод о том, что соединение относится к алкенам, алкинам, аренам или алкадиенам.
Возможный вариант один (исходя из существующих общих формул указанных выше классов безкислородных органических веществ): C6H5Cl — хлорбензол
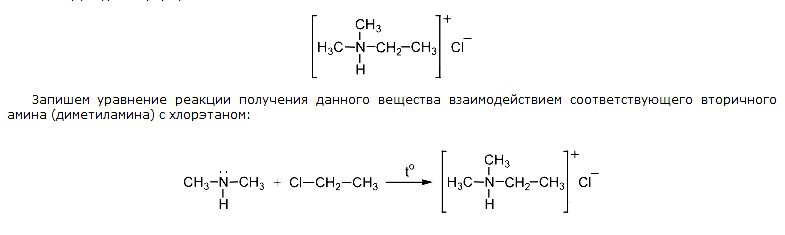
Реальный ЕГЭ по химии 2018. Задание 35. Вариант 9. Некоторое вещество содержит по массе 12,79% азота, 43,84% углерода и 32,42 % хлора и образуется при взаимодействии первичного амина с хлорэтаном. Определите молекулярную и структурную формулу вещества.
Решение
Массовая доля водорода составляет 100% — 12,79% — 43,84% — 32,42% = 10,95%
Найдем соотношение количества вещества углерода, водорода, азота и хлора.
Примем массу соединения за 100 грамм, тогда количество вещества элементов следующее:
n(N) = 12,79/14 = 0,91
n(С) = 43,84/12 = 3,65
n(Сl) = 32,42/36,5 = 0,9
n(H) = 10,95
Соотношение азота к углероду к хлору и к водороду 1:4:1:12.
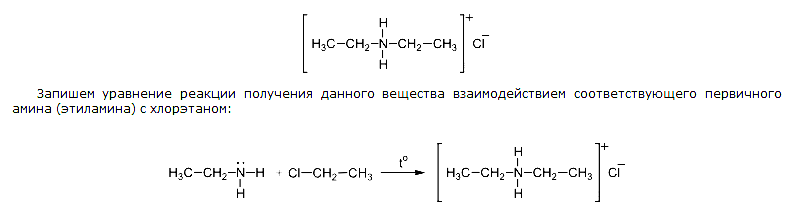
При взаимодействии первичного амина с хлорэтаном получится [(CH3-CH2)2-NH2]+Cl—
Реальный ЕГЭ по химии 2018. Задание 35. Вариант 11. Органическое вещество содержит 12,79% азота, 10,95% водорода и 32,42% хлора. Вещество может быть получено при взаимодействии вторичного амина с хлорэтаном. Определите молекулярную и структурную формулу вещества.
Решение
Массовая доля углерода составляет 100% — 12,79% — 10,95% — 32,42% = 43,84%
Найдем соотношение количества вещества углерода, водорода, азота и хлора.
Примем массу соединения за 100 грамм, тогда количество вещества элементов следующее:
n(N) = 12,79/14 = 0,91
n(С) = 43,84/12 = 3,65
n(Сl) = 32,42/36,5 = 0,9
n(H) = 10,95
Соотношение азота к углероду к хлору и к водороду 1:4:1:12.
При взаимодействии вторичного амина с хлорэтаном получится диметилэтиламина хлорид
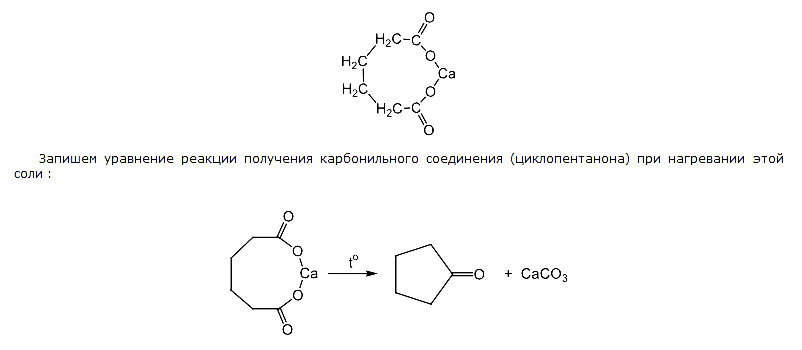
[СН3-N(CH3)-C2H5]+Cl—Реальный ЕГЭ по химии 2018. Задание 35. Вариант 12. Соль органической кислоты содержит 4,35% водорода, 39,13% углерода, 34,78% кислорода и 21,74% кальция. При нагревании этой соли образуется карбонильное соединение. Определите молекулярную и структурную формулу вещества.
Решение
Общая формула вещества: CxHyOzСa
Примем массу соединения за 100 грамм, тогда количество вещества элементов следующее:
n(С) = 39,13/12 = 3,26
n(Н) = 4,35/1 = 4,35
n(O) = 34,78/16 = 2,17
n(Сa) = 21,74/40 = 0,54
Соотношение элементов в искомой соли следующее:
6 : 8 : 4 : 1 (С : Н : О : Са)
Молекулярная формула вещества С6Н8О4Са
Учитывая соотношение углерода и водорода, характерное для непредельной одноосновной кислоты или предельной двухосновной кислоты, а также реакцию образования карбонильного соединения при нагревании, можно сделать вывод, что речь о кальциевой соли бутан-1,2-дикарбоновой кислоты
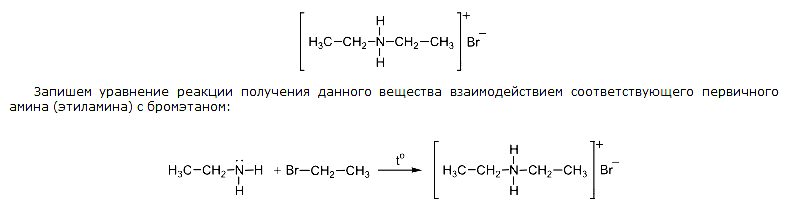
Реальный ЕГЭ по химии 2018. Задание 35. Вариант 13. Органическое вещество содержит 9,09% азота, 31,19% углерода и 51,87% брома. Вещество может быть получено при взаимодействии первичного амина с бромэтаном. Определите молекулярную и структурную формулу вещества.
Решение
Массовая доля водорода составляет 100% — 9,09% — 31,19% — 51,87% = 7,85%
Найдем соотношение количества вещества углерода, водорода, азота и брома.
Примем массу соединения за 100 грамм, тогда количество вещества элементов следующее:
n(N) = 9,09/14 = 0,65
n(С) = 31,19/12 = 2,6
n(Br) = 51,87/80 = 0,65
n(H) = 7,85
Соотношение азота к углероду к брому и к водороду 1:4:1:12.
При взаимодействии первичного амина с бромэтаном получится диэтиламина бромид
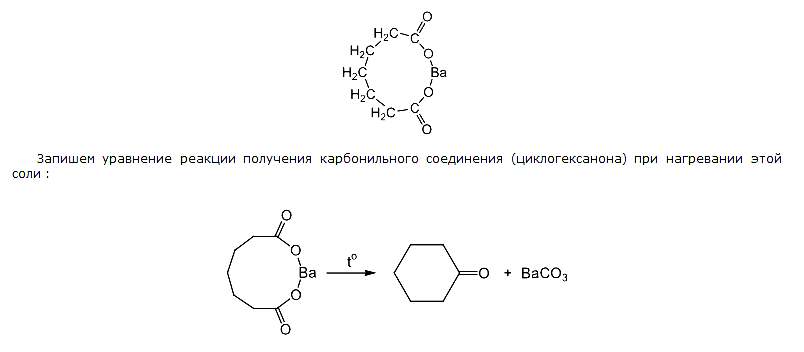
[(CH3-CH2)2-NH2]+Br—Реальный ЕГЭ по химии 2018. Задание 35. Вариант 14. Соль органической кислоты содержит 28,48% углерода, 3,39% водорода, 21,69% кислорода и 46,44% бария. При нагревании этой соли образуется карбонильное соединение. Определите молекулярную и структурную формулу вещества.
Решение
Общая формула вещества: CxHyOzBa
Примем массу соединения за 100 грамм, тогда количество вещества элементов следующее:
n(С) = 28,48/12 = 2,37
n(Н) = 3,39/1 = 3,39
n(O) = 21,69/16 = 1,36
n(Ba) = 46,44/137 = 0,34
Соотношение элементов в искомой соли следующее:
7 : 10 : 4 : 1 (С : Н : О : Ва)
Молекулярная формула вещества С7Н10О4Ва
Учитывая соотношение углерода и водорода, характерное для непредельной одноосновной кислоты или предельной двухосновной кислоты, а также реакцию образования карбонильного соединения при нагревании, можно сделать вывод, что речь о бариевой соли пентан-1,2-дикарбоновой кислоты
Реальный ЕГЭ по химии 2018. Задание 35. Вариант 15. Органическое вещество содержит 10% азота, 25,73% углерода и 57,07% брома. Вещество может быть получено при взаимодействии первичного амина с бромметаном. Определите молекулярную и структурную формулу вещества.
Решение
Массовая доля водорода составляет 100% — 10% — 25,73% — 57,07% = 7,2%
Найдем соотношение количества вещества углерода, водорода, азота и брома.
Примем массу соединения за 100 грамм, тогда количество вещества элементов следующее:
n(N) = 10/14 = 0,7
n(С) = 25,73/12 = 2,1
n(Br) = 57,07/80 = 0,7
n(H) = 7,2
Соотношение азота к углероду к брому и к водороду 1:3:1:10.
При взаимодействии первичного амина с бромметаном получится метилэтиламина бромид
[(CH3-CH2-NH2-CH3]+Br—Реальный ЕГЭ по химии 2018. Задание 35. Вариант 16. Соль органической кислоты содержит 25,62% углерода, 2,85% водорода, 22,78% кислорода и 48,75% бария. При нагревании этой соли образуется карбонильное соединение. Определите молекулярную и структурную формулу вещества.
Решение
Общая формула вещества: CxHyOzBa
Примем массу соединения за 100 грамм, тогда количество вещества элементов следующее:
n(С) = 25,62/12 = 2,135
n(Н) = 2,85/1 = 2,85
n(O) = 22,78/16 = 1,42375
n(Ba) = 48,75/137 = 0,356
Соотношение элементов в искомой соли следующее:
6 : 8 : 4 : 1 (С : Н : О : Ва)
Молекулярная формула вещества С6Н8О4Ва
Учитывая соотношение углерода и водорода, характерное для непредельной одноосновной кислоты или предельной двухосновной кислоты, а также реакцию образования карбонильного соединения при нагревании, можно сделать вывод, что речь о бариевой соли бутан-1,2-дикарбоновой кислоты
Реальный ЕГЭ по химии 2018. Задание 35. Вариант 17. При сгорании 40 г органического соединения образовалось 4,48 л СО2 и 2,88 г Н2О. Вещество обесцвечивает бромную воду и вступает в реакцию с раствором гидроксида бария при нагревании, один из продуктов имеет формулу С6Н6О4Ва. Определите молекулярную и структурную формулу вещества.
Решение
Искомое вещество содержит кратную углерод-углеродную связь, так как обесвечивает бромную воду.
Учитывая информацию о реакции вещества с гидроксидом бария с образованием органической соли бария мы можем сделать вывод, что искомое вещество содержит либо карбоксильную группу, либо сложноэфирную связь.
Общая формула вещеста СxHyOz
Найдем соотношение количеств вещества углерода и водорода:
n(С) = 4,48/22,4 = 0,2
n(Н) = 2,88*2/18 = 0,32
Таким образом соотношение количеств вещества углерода и водорода составляет 5 : 8
Учитывая формулу продукта, указанного в условии, делаем вывод, что кислота пропеновая: СН2=СН-С(О)-О-Ва-О-С(О)-СН=СН2
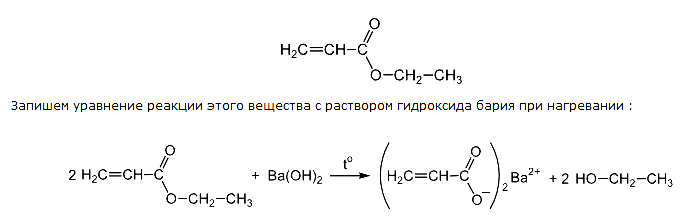
Таким образом, искомое вещество это сложный эфир пропеновой кислоты, учитывая соотношение найденное соотношение делаем вывод, что речь об этиловом эфире пропеновой кислоты: СН2=СН-С(О)-О-С2Н5