Ароматические углеводороды (Арены) – это органические соединения, в молекулах которых имеется одно или несколько бензольных колец. Бензольное кольцо, или ядро, – циклическая группа атомов углерода с особым характером связей.
Общая формула — CnH2n-6
1. Представители:
МОНОЯДЕРНЫЕ
1. С6H6 – бензол, родоначальник гомологического ряда аренов
2. С6H5 – CH3 – толуол (метилбензол)
3. С6H5 – CH=СH2 – стирол (винилбензол)
4. Ксилол (орто-, пара- , мета-ксилол)
МНОГОЯДЕРНЫЕ (КОНДЕНСИРОВАННЫЕ)
1. Нафталин
2. Антрацен
2. Строение ароматических углеводородов
| SP2 –гибридизация:
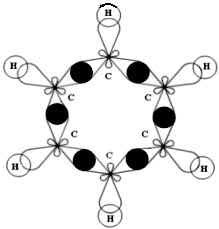
1. Плоское тригональное строение 2. Угол – HCH — 120° 3. Связи σ, π 4. В бензоле нет простых и двойных связей, под влиянием единой π – электронной системы расстояние между центрами атомов углерода становится одинаковым – 0,139 нм, все связи полуторные |
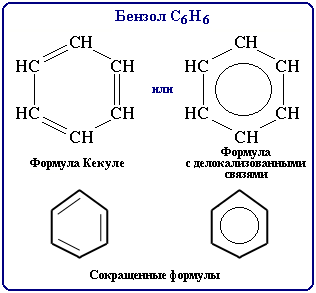
Первую структурную формулу бензола предложил в 1865 г. немецкий химик Ф.А.Кекуле:
Атомы С в молекуле бензола образуют правильный плоский шестиугольник, хотя часто его рисуют вытянутым.
Приведенная формула правильно отражает равноценность шести атомов С, однако не объясняет ряд особых свойств бензола. Например, несмотря на ненасыщенность, он не проявляет склонности к реакциям присоединения: не обесцвечивает бромную воду и раствор перманганата калия, т.е. ему не свойственны типичные для непредельных соединений качественные реакции.
В структурной формуле Кекуле – три одинарные и три двойные чередующиеся углерод-углеродные связи. Но такое изображение не передает истинного строения молекулы. В действительности углерод-углеродные связи в бензоле равноценны. Это объясняется электронным строением его молекулы.
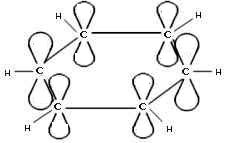
Каждый атом С в молекуле бензола находится в состоянии sp2-гибридизации. Он связан с двумя соседними атомами С и атомом Н тремя σ -связями. В результате образуется плоский шестиугольник, где все шесть атомов С и все σ -связи С–С и С–Н лежат в одной плоскости (угол между связями С–С равен 120o).
Рис. Схема образования -связей в молекуле бензола.
Третья p-орбиталь атома углерода не участвует в гибридизации. Она имеет форму гантели и ориентирована перпендикулярно плоскости бензольного кольца. Такие p-орбитали соседних атомов С перекрываются над и под плоскостью кольца.
Рис. Негибридные 2p-орбитали углерода в молекуле бензола
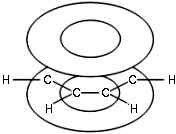
В результате шесть p-электронов (всех шести атомов С) образуют общее π -электронное облако и единую химическую связь для всех атомов С.
Рис. Молекула бензола. Расположение π -электронного облака
π -Электронное облако обусловливает сокращение расстояния между атомами С.
В молекуле бензола они одинаковы и равны 0,139 нм. В случае простой и двойной связи эти расстояния составили бы соответственно 0,154 и 0,134 нм. Значит, в молекуле бензола нет чередования простых и двойных связей, а существует особая связь – “полуторная” – промежуточная между простой и двойной, так называемая ароматическая связь. Чтобы показать равномерное распределение p-электронного облака в молекуле бензола, корректнее изображать ее в виде правильного шестиугольника с окружностью внутри (окружность символизирует равноценность связей между атомами С):
Гомологи бензола. Номенклатура и изомерия
Гомологи бензола – соединения, образованные заменой одного или
нескольких атомов водорода в молекуле бензола на углеводородные
радикалы (R):
С6Н5—R (алкилбензол), R—С6Н4—R (диалкилбензол) и т.д.
Общая формула гомологического ряда бензола СnH2n-6 (n не менее 6).
Номенклатура. Широко используются тривиальные названия (толуол, ксилол, кумол и т.п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова бензол (корень):
С6Н5—СH3 С6Н5—С2H5 С6Н5—С3H7
метилбензол этилбензол пропилбензол
(толуол)
Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Нумерацию кольца проводят так, чтобы номера радикалов были наименьшими.
Для дизамещенных бензолов R-С6Н4—R используется также и другой способ построения названий, при котором положение заместителей указывают перед тривиальным названием соединения приставками:
орто— (о-) заместители у соседних атомов углерода кольца, т.е. 1,2;
мета— (м-) заместители через один атом углерода (1,3);
пара— (п-) заместители на противоположных сторонах кольца (1,4).
Ароматические одновалентные радикалы имеют общее название «арил«.
Из них наиболее распространены в номенклатуре органических соединений два: С6Н5— фенил и С6Н5-СH2— бензил.
Изомерия (структурная):
1) положения заместителей для ди-, три— и тетра-замещенных бензолов (например, о-, м— и п-ксилолы,;
2) углеродного скелета в боковой цепи, содержащей не менее 3-х атомов углерода;
3) изомерия заместителей, начиная с С2Н5.
Например, молекулярной формуле С8Н10 соответствует 4 изомера: три ксилола СH3—С6Н4—СH3 (о-, м-, п-) и этилбензол С6Н5—С2H5.
Пространственная изомерия относительно бензольного кольца в алкилбензолах отсутствует.