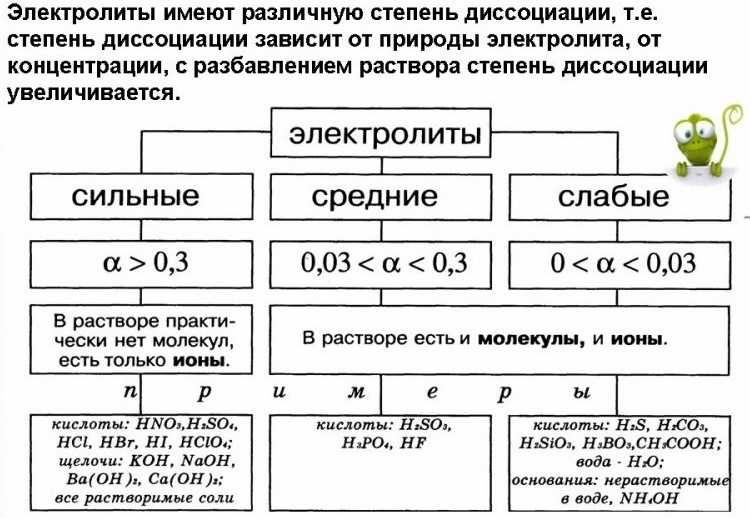
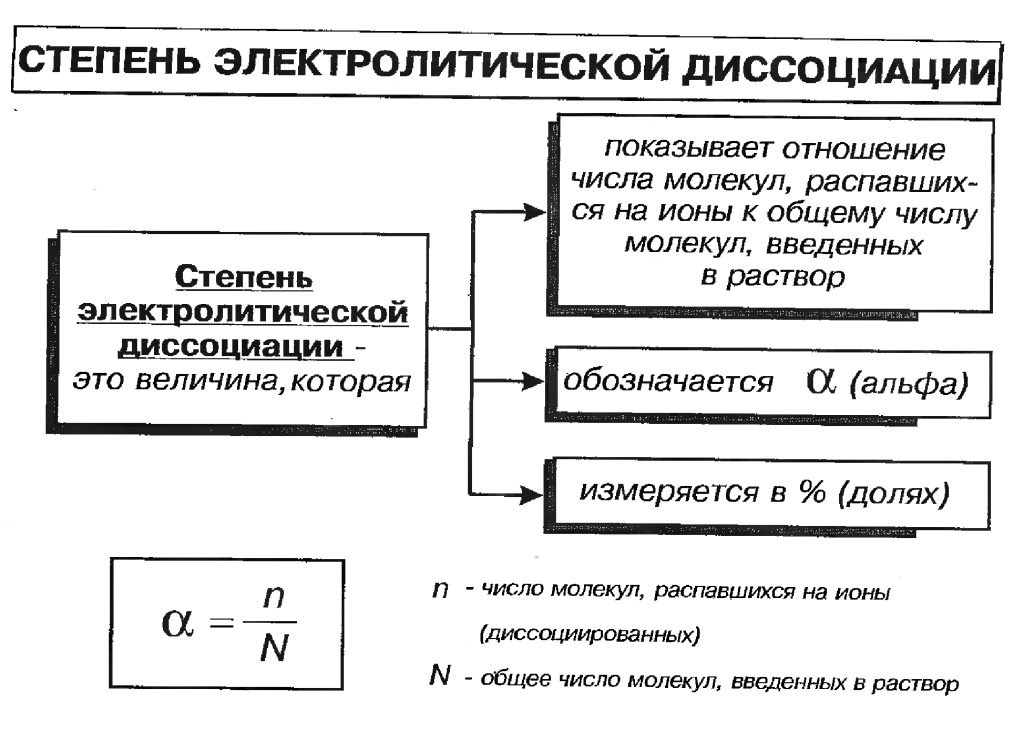
Диссоциация характеризуется степенью электролитической диссоциации a — числом, показывающим, какая часть молекул электролита находится в растворе в виде ионов, т.е. как отношение продиссоциировавших молекул к общему числу молекул в растворе. Обычно ее выражают в долях единицы или в процентах. В растворах неэлектролитов, где распад на ионы полностью отсутствует, a = 0, а в растворах, в которых все растворенное вещество присутствует в форме ионов, a = 1. Такое деление является в значительной степени условным, что объясняется зависимостью степени диссоциации от природы электролита и растворителя, концентрации и температуры раствора.
К сильным электролитам относят вещества, которые практически полностью диссоциируют на ионы, a » 1. Это сильные кислоты, гидроксиды и почти все соли. Слабыми электролитами считаются вещества, диссоциирующие на ионы в незначительной степени ( a < 0.3). В основном это слабые кислоты и многие основания, у которых большая часть растворенного вещества находится в молекулярной форме. Существует также небольшая группа электролитов средней силы, у которых степень диссоциации a больше 0.3 и меньше 0.7.
Теория электролитической диссоциации справедлива только к растворам слабых электролитов. Сильные электролиты диссоциируют полностью, создавая значительную концентрацию ионов в растворе. Их ионы в растворах как бы окружены оболочкой полярных молекул растворителя, что приводит к уменьшению скорости движения ионов. В результате степень диссоциации меньше единицы, хотя реально в растворе присутствуют только ионы. Такую экспериментальную величину называют кажущейся степенью диссоциации.
Диссоциация слабых электролитов – обратимый процесс. Его можно представить как
AB « A+ + B—
Применяя закон действующих масс, получаем выражение для константы диссоциации:
К = ([A+]*[ B—])/[AB]
Константа диссоциации зависит от природы электролита и температуры.
 Примеры задач на степень диссоциации\
Примеры задач на степень диссоциации\
Также вы можете посмотреть ВИДЕО-уроки на эту тему:
И выполнить задания из ЦТ и ЕГЭ на эту тему вы можете здесь
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку