Предлагаем вашему вниманию седьмой пробный вариант для подготовки к ЦТ по химии 2021: ответы представлены в конце страницы.
Скачать РТ 2020/2021 вариант 7
ВНИМАНИЕ: все задания составлены автором самостоятельно и не являются копией заданий ЦТ и РТ. Если вам необходимы оригинальные задания, то вам надо записываться на этапы РТ (на сайте РИКЗ) и покупать сборники реальных заданий ЦТ и РТ в книжных магазинах.
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
Вариант 7
Для получения полного доступа к сайту переходите по ссылке: http://www.yoursystemeducation.com/poluchit-video/. В полном доступе вы найдёте условия и видео-объяснения заданий-аналогов из всех этапов РТ начиная с 2014 года, а также всех заданий-аналогов ЦТ начиная с самого первого ЦТ 2004 года.
Вариант содержит 44 задания и состоит из части А (28 заданий) и части В (16 заданий). На выполнение всего теста отводится 150 минут. Необходимые справочные материалы – «Периодическая система химических элементов Д.И. Менделеева», «Растворимость кислот, оснований и солей в воде», Электрохимический ряд активности металлов» — приведены в конце теста.
При расчётах принять молярный объём газа (Vm) 22,4 дм3/моль. Значения относительных атомных масс химических элементов (кроме хлора, для которого Ar = 35,5) следует округлять до целого числа. При решении заданий можно пользоваться микрокалькулятором.
Часть А
Для получения приближённого значения чисел в промежуточных расчётах округлите их до третьего знака после запятой по правилам округления. Конечный результат округлите, ориентируясь на числа, предложенные в ответе.
В каждом задании только ОДИН из предложенных вариантов ответа является верным.
А1. К халькогенам и галогенам соответственно относятся химические элементы, представленные в рядах:
1) Si, P, As, Ge и F, Cl, Br, I
2) O, S, Se, Te и Cl, Br, I, At
3) O, S, Se, Te и F, P, S, Cl
4) Cl, Br, I, At и Si, P, As, Ge
5) C, Si, Sn, Pb и He, Ne, Ar, Xe
А2. Распределение электронов на внешнем энергетическом уровне в атоме кислорода в основном состоянии представлено схемой:
1) 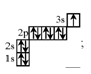 2)
2)  3)
3)  4)
4)  5)
5) 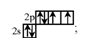 А3. Кислотные свойства летучих водородных соединений последовательно увеличиваются у элементов ряда:
А3. Кислотные свойства летучих водородных соединений последовательно увеличиваются у элементов ряда:
1) Сl, Br, I
2) Te, Se, S
3) As, P, N
4) Li, Na, K
5) Na, S, Cl
А4. Укажите молекулу, содержащую кратную связь:
1) PH3
2) F2
3) SO2
4) HCl
5) HClO
А5. Укажите вещество, в котором углерод проявляет валентность IV и степень окисления -4:
1) CCl4
2) CH3F
3) Al4C3
4) CaC2
5) CO
А6. Установите соответствие между названием вещества и типом его кристаллической решётки в твёрдом агрегатном состоянии:
| Название вещества | Тип решётки |
| 1) питьевая сода
2) вольфрам 3) селеноводород 4) кремний |
а) атомная
б) ионная в) металлическая г) молекулярная |
1) 1г, 2в, 3б, 4а
2) 1б, 2а, 3в, 4г
3) 1а, 2в, 3г, 4б
4) 1в, 2б, 3г, 4а
5) 1б, 2в, 3г, 4а
А7. Укажите пару веществ, у которых совпадает качественный состав:
1) H2O и H2S
2) HCl и HClO4
3) NaBr и NaF
4) C2H2 и CH4
5) Fe(OH)2 и FeO
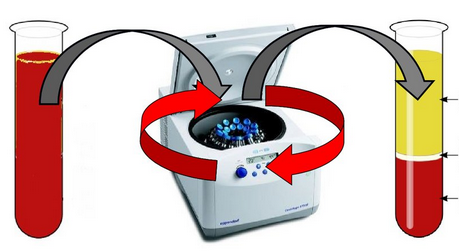
А8. Укажите метод разделения смесей, который представлен на рисунке:
2) отстаивание
3) выпаривание
4) центрифугирование
5) перекристаллизация
А9. Кислота, соль и оксид соответственно представлены формулами:
1) HClO4, ZnI2, CrO3
2) HCl, NO, KBr
3) H2S, NaHCO3, Na2O2
4) Fe(OH)2, HBr, BaSO4
5) HCN, K3[Al(OH)6], BaO2
А10. Выберите гидроксид, который реагирует с разбавленными растворами щелочей и кислот:
1) H2ZnO2
2) H2SO3
3) Mg(OH)2
4) KHCO3
5) NaOH
А11. Кислота образуется при взаимодействии веществ (20С, электролиты представлены в виде водных растворов):
а) NO2 + H2O + O2;
б) NaHCO3 + NaOH;
в) Cl2O7 + H2O;
г) K2ZnO2 + HBr;
д) Ba(NO3)2 + H2SO4;
е) AgF + HI;
1) а, б, г
2) а, д, е
3) б, в, е
4) в, г, д
5) а, б, д
А12. Две соли могут образоваться при взаимодействии веществ (электролиты представлены в виде разбавленных водных растворов):
1) сероводород и гидроксид калия
2) сульфит натрия и оксид серы (IV)
3) аммиак и соляная кислота
4) нитрат серебра (I) и иодоводород
5) сульфид натрия и хлорид алюминия
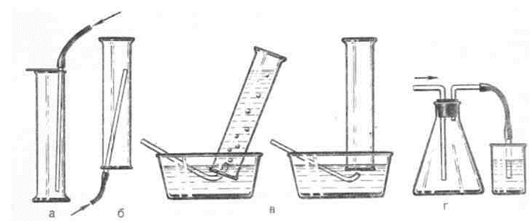
А13. Водород можно собрать с помощью приборов:
2) а, б, в
3) б, г
4) а, в, г
5) а, в
А14. Растворы бромида калия и иодида цезия можно различить с помощью:
а) хлора (н.у.);
б) раствора хлороводорода;
в) раствора нитрата серебра;
г) раствора хлорида кальция;
1) а, б
2) а, в
3) б, г
4) в, г
5) а, г
А15. Выберите верное утверждение:
1) на рисунке изображён кристалл моноклинной серы
 2) кислород проявляет восстановительные свойства при взаимодействии с серой
2) кислород проявляет восстановительные свойства при взаимодействии с серой
3) кислород в лаборатории можно получить нагреванием оксида цинка
4) кислород, как и озон, НЕ реагирует ни с серебром, ни с золотом
5) сера хорошо растворяется в воде
А16. Аммиак образуется в результате превращений:
а) NH4NO3 (тв.) + Ca(OH)2 (тв.) (сплавление );
б) NH4Cl (прокаливание );
в) Cu(NO3)2 (прокаливание );
г) Ba(NO3)2 + H2SO4 (р-р);
1) а, в
2) б, г
3) а, б
4) в, г
5) а, г
А17. Углеродсодержащие вещества А, Б, В соответственно в схеме превращений
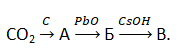 Относятся к классам неорганических веществ:
Относятся к классам неорганических веществ:
1) кислота, оксид, соль
2) оксид, соль, соль
3) оксид, соль, кислота
4) оксид, оксид, соль
5) карбид, оксид, основание
А18. При 20С насыщенным НЕ будет концентрированный водный раствор вещества:
1) этанол
2) питьевая сода
3) каустическая сода
4) железный купорос
5) ацетат натрия
А19. К смеси карбоната и сульфата калия прилили избыток воды. Затем в образовавшийся раствор прилили избыток раствора серной кислоты. К образовавшемуся раствору добавили избыток раствора нитрата бария. В конечном растворе находятся ионы (растворимостью газов и осадков пренебречь):
1) K+, Ba2+, H+, NO3—
2) K+, H+, NO3—
3) K+, Ba2+, H+, NO3—, SO42-
4) K+, Ba2+, NO3—,
5) K+, Ba2+, Н+
А20. Расставьте коэффициенты Cr2(SO4)3 + I2 + KOH → K2CrO4 + KI + K2SO4 + H2O. Сумма коэффициентов перед формулами продукта окисления и продукта восстановления:
1) 4
2) 8
3) 12
4) 20
5) 26
А21. Число изомерных углеводородов, имеющих относительную молекулярную массу 86, равно:
1) 4
2) 5
3) 6
4) 7
5) 8
А22. В реакции присоединения брома к 3-метилпентену-2 образуется соединение:
1) 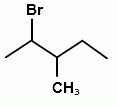 2)
2)  3)
3) 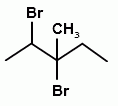 4)
4) 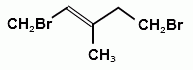 5)
5) 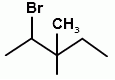 А23. Медную проволоку прокалили на воздухе, а затем опустили в раствор пропанола-1. Основным органическим продуктом реакции является:
А23. Медную проволоку прокалили на воздухе, а затем опустили в раствор пропанола-1. Основным органическим продуктом реакции является:
1) этанол
2) уксусная кислота
3) пропановая кислота
4) пропаналь
5) ацетон
А24. Дана схема превращений: ![]() Укажите названия веществ А и Б соответственно:
Укажите названия веществ А и Б соответственно:
1) нитробензол, фенол
2) пикриновая кислота, фенол
3) нитробензол, циклогексан
4) нитробензол, анилин
5) анилин, фенол
А25. Водный раствор пропионовой кислоты имеет значение рН …… и ….. среду. Окраска метилоранжа в растворе этой кислоты ….. Вставьте недостающие части соответственно:
1) больше 7, кислую, красную
2) больше 7, щелочную, оранжевую
3) меньше 7, кислую, красную
4) меньше 7, кислую, желтую
5) меньше 7, щелочную, красную
А26. Укажите название вещества, с которым может реагировать и глицерин, и глюкоза:
1) ацетальдегид
2) гидроксид меди (II)
3) водород
4) цинк
5) аммиачный раствор оксида серебра (I)
А27. Азотсодержащий продукт сгорания аминов в кислороде:
1) азот
2) веселящий газ
3) аммиак
4) лисий хвост
5) аминокислота
А28. В результате реакции полимеризации может образовываться вещество:
1) природный каучук
2) полистирол
3) глюкоза
4) лавсан
5) этилен
Часть В
При решении задач в промежуточных расчётах для получения приближенного значения чисел округлите их до третьего знака после запятой по правилам округления, а конечный результат – до целого числа. Единицы измерения числовых величин не указывайте.
В1. При крекинге алифатического нециклического углеводорода А образуются только два соединения (Б и Г) с одинаковым числом атомов углерода в молекуле. Вещество Б под действием нагревания в присутствии хлорида алюминия превращается в вещество В, окислением которого в присутствии солей двухвалентных кобальта и марганца при нагревании в промышленности получают уксусную кислоту. Другой продукт крекинга Г имеет разветвлённый углеродный скелет. Установите соответствие между буквой зашифрованного вещества и его названием.
| Вещество | Название |
| А
Б В Г |
1) 2-метилгептан
2) октан 3) бутан 4) 2-метилпропен 5) бутен 6) изобутан 7) 2,5-диметилгексан |
Ответ запишите в виде сочетания букв и цифр, например: А1Б5В6Г2.
В2. Выберите утверждения, характеризующие вещество с молекулярной формулой С6Н5ОН:
1) реагирует со щелочами и кислотами;
2) называется фенол;
3) является ароматическим спиртом;
4) кислотные свойства выражены слабее, чем у бутанола-1;
5) при взаимодействии с бромной водой образует белый осадок;
6) твёрдое вещество при н.у.;
7) является более слабой кислотой по сравнению с этановой кислотой;
Ответ запишите цифрами по порядку, например: 1256.
В3. Укажите сумму молярных масс (г/моль) веществ зашифрованных буквами, образовавшихся в результате превращений (1 молекула вещества А содержит 1 атом брома):
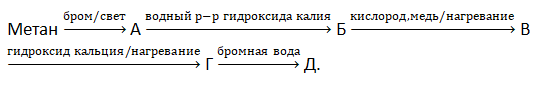 В4. Водород объёмом 15 дм3 добавили к смеси объёмом 42 дм3, состоящей из пропина и метана. Затем в сосуд с образовавшейся смесью газов герметично опустили платиновый катализатор и нагрели смесь до 150С. После полного завершения реакции объём смеси стал равен 54 дм3. Рассчитайте объёмную долю (%) метана в исходной смеси газов.
В4. Водород объёмом 15 дм3 добавили к смеси объёмом 42 дм3, состоящей из пропина и метана. Затем в сосуд с образовавшейся смесью газов герметично опустили платиновый катализатор и нагрели смесь до 150С. После полного завершения реакции объём смеси стал равен 54 дм3. Рассчитайте объёмную долю (%) метана в исходной смеси газов.
В5. После полного сжигания метиламина в необходимом количестве кислорода и приведения к нормальным условиям образовалась газовая смесь объёмом 6,72 дм3. Рассчитайте объём кислорода (дм3), затраченного на сгорание метиламина.
В6. Укажите сумму молярных масс (г/моль) бериллийсодержащего вещества Г и кремнийсодержащего вещества Е, образующихся в результате превращений:
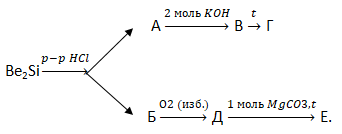 В7. Выберите три утверждения, верно характеризующие железо.
В7. Выберите три утверждения, верно характеризующие железо.
- Относится к группе тугоплавких металлов.
- При нагревании реагирует с водой с образованием Fe(OH)3.
- Обладает магнитными свойствами.
- Вытесняет цинк из водных растворов его солей.
- Окислительные свойства иона Fe2+ в водном растворе выражены слабее, чем у иона Fe3+.
- При взаимодействии с соляной кислотой образуется хлорид железа (II) и водород.
Ответ запишите цифрами по порядку, например: 125.
В8. В пяти пронумерованных пробирках находятся вещества: пропаналь, бутанол-1, анилин, бутен-2-овая кислота, бромная вода. О них известно следующее:
— при сливании содержимого пробирок 1 и 5, а также 3 и 5 наблюдается только обесцвечивание раствора;
— вещество из пробирки 4 реагирует только с веществом из пробирки 3;
— при сливании содержимого пробирок 2 и 5 раствор обесцвечивается и выпадает осадок.
Установите соответствие между названием содержимого и номером пробирки.
| НАЗВАНИЕ ВЕЩЕСТВ | НОМЕР ПРОБИРКИ |
| А. Пропаналь (водный р-р)
Б. Бутанол-1 В. Анилин Г. Бутен-2-овая кислота Д. Бромная вода |
1
2 3 4 5 |
Ответ запишите в виде сочетания букв и цифр, например: А2Б5В1Г3Д4.
В9. При действии гидроксида бария на раствор соли А образуется осадок соли Б (в природе встречается в виде минерала витерита). Приливание к А раствора нитрата бария не приводит к химическим изменениям. Азотная кислота реагирует с А с выделением газа В (н.у.), не поддерживающего горение. Пропускание водного раствора В через соль Б ведёт к образованию исходной соли А. При нагревание А разлагается с образованием Б. Продуктом спекания гидроксида цинка с Б является соль Г. Укажите сумму молярных масс (г/моль) неорганических веществ В и Г.
В10. Установите соответствие между уравнением обратимой реакции и смещением равновесия, которое произойдёт при одновременном повышении давления и увеличении температуры.
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ РАВНОВЕСИЯ |
| А. Н2(г) + F2(г) ↔ 2HF(г) + Q
Б. SO2Cl2(г) ↔ SO2(г) + Cl2(г) – Q В. 2NH3(г) ↔ N2(г) +3H2(г) + Q Г. H2(г) + CO2(г) ↔ CO(г) + H2O(г) –Q |
1) в сторону исходных веществ
2) в сторону продуктов 3) в противоположных направлениях |
Учтите, что данные правого столбика могут повторяться. Ответ запишите в виде сочетания букв и цифр, например: А2Б1В3Г3.
В11. Массовая доля соли в растворе калийной селитры (удобрение) солставляет 15%. Масса раствора составляет 410 г. Укажите формулу, группу удобрения, массу соли в растворе и суммарную массу питательных элементов в растворе. Установите соответствие между столбцами:
| А. Суммарная масса (г) питательных элементов в растворе
Б. Масса (г) соли в растворе В. Формула удобрения Г. Группа удобрения |
1) 61,5
2) 8,52 3) 23,75 4) простые 5) комплексные 6) смешанные 7) KNO3 8) KHCO3 9) Ca(NO3)2 10) 32,27 |
Ответ запишите в виде сочетания букв и цифр, например: А1Б4В3Г8.
В12. Рассчитайте массу (г) твёрдого гидроксида калия, который израсходовали на получение фосфата калия массой 118,72 г по схеме превращений KOH → KH2PO4 → K2HPO4 → K3PO4, если на каждой стадии выход продукта реакции составляет 80%.
В13. Химическая реакция протекает согласно термохимическому уравнению:
BaO (т) + SO2 (г) = BaSO3 (т) + 65 кДж. Установите соответствие:
| Количественные данные | Количество выделившейся теплоты (кДж) |
| А. m(BaO) = 61,2 г
Б. V(SO2) = 14,56 дм3 В. m(BaSO3) = 26,04 г Г. N(O) в BaSO3 = 5,418∙1024 |
1. 42,25
2. 7,8 3. 26 4. 195 |
Ответ запишите в виде сочетания букв и цифр, например: А1Б4В3Г2.
В14. Имеется два одинаковых сосуда с раствором карбоната натрия. В один из них прилили соляную кислоты массой 40 г, содержащую хлороводород массой 14,6 г, который полностью прореагировал с солью. Рассчитайте массу (г) 100% серной кислоты, которую необходимо добавить во второй сосуд с карбонатом натрия, чтобы массы сосудов уравнялись. Растворимостью газов пренебречь.
В15. Массовая доля серы в олеуме массой 35,6 г составляет 36%. Рассчитайте массу (г) раствора гидроксида натрия с массовой долей щёлочи 15%, который необходим для полной нейтрализации данного олеума.
В16. В карбоновую трубку поместили порошок металла Х массой 15,36 г и пропустили по трубке ток очищенного хлора при нагревании до 700С и повышенном давлении. Через некоторое время металл полностью прореагировал, а в конце трубки накопились коричневые кристаллы вещества Y массой 26,72 г. Длительное нагревание Y в токе водорода приводит к образованию X и газа Z, который при растворении в воде даёт сильную неорганическую кислоту. Вещество Y состоит из пятиатомных молекул, содержащих один атом металла. Укажите молярную массу (г/моль) металла X.
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
Ответы:
Часть А:
- 2
- 5
- 1
- 3
- 3
- 5
- 4
- 4
- 1
- 1
- 2
- 1
- 1
- 2
- 1
- 3
- 4
- 1
- 1
- 2
- 2
- 3
- 4
- 4
- 3
- 2
- 1
- 2
Часть В:
- А7Б6В3Г4
- 2567
- 533
- 96
- 10
- 125
- 356
- А1Б4В2Г3Д5
- 278
- А1Б3В1Г2
- А10Б1В7Г5
- 184
- А3Б1В2Г4
- 57
- 214
- 192
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
Посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»
- Посмотреть все пробные варианты ЦТ 2021 вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Больше заданий РТ вы можете найти здесь, нажав на эту строку
- Больше заданий ЦТ вы можете найти здесь, нажав на эту строку
- Наш канал на YouTube вы можете посмотреть, нажав на эту строку