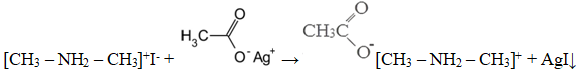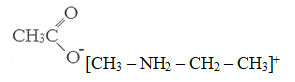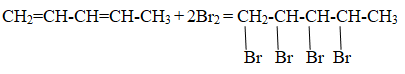Реальный ЕГЭ по химии 2019. Задание 35
Представляем вашему вниманию задание 35 из реального ЕГЭ 2019 и резервных дней основного периода (31 мая 2019 года, 20 июня 2019 года и 1 июля 2019 года) с подробными видео-объяснениями, текстовыми решениями и ответами + досрочный ЕГЭ 2019 + демо 2019.
ВНИМАНИЕ — в ЕГЭ 2022 года это будет задание 34
Реальный ЕГЭ 2019. Задание 35. Вариант 1.
Органическое вещество содержит 3,41% водорода, 34,09% углерода, 36,36% кислорода и 26,14 натрия по массе. Известно, что при нагревании этого вещества с избытком гидроксида натрия образуется предельный углеводород. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции, протекающей при нагревании исходного вещества с избытком гидроксида натрия.
Реальный ЕГЭ 2019. Задание 35. Вариант 2.
Органическое вещество, массовая доля углерода в котором равна 45,45%, водорода – 6,06%, кислорода – 48,48%, при нагревании реагирует с водным раствором гидроксида натрия, образуя два спирта и соль органической кислоты. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакциитисходного вещества с водным раствором гидроксида натрия.
Реальный ЕГЭ 2019. Задание 35. Вариант 3.
Органическое вещество, массовая доля углерода в котором равна 49,31%, кислорода – 43,84%, при нагревании реагирует с водным раствором гидроксида натрия, образуя этанол и соль органической кислоты. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции исходного вещества с водным раствором гидроксида натрия.
Решение этой задачи смотрите в следующем варианте, так как они абсолютно аналогичные.
Реальный ЕГЭ 2019. Задание 35. Вариант 4.
Органическое вещество, массовая доля водорода в котором равна 6,85%, кислорода – 43,84%, при нагревании реагирует с водным раствором гидроксида натрия, образуя этанол и соль органической кислоты. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции исходного вещества с водным раствором гидроксида натрия.
Реальный ЕГЭ 2019. Задание 35. Вариант 5.
Органическое вещество содержит 9,43% водорода, а также углерод и кислород, массовые доли которых равны. Известно, что это вещество реагирует с натрием и со свежеосажденным гидроксидом меди(II), молекула его содержит третичный атом углерода. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции исходного вещества с избытком натрия.
Реальный ЕГЭ 2019. Задание 35. Вариант 6.
При сжигании образца органического вещества массой 3,8 г получено 3,36 л (н.у.) углекислого газа и 3,6 г воды. Известно, что это вещество реагирует с натрием и со свежеосажденным гидроксидом меди(II). На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции исходного вещества с избытком азотной кислоты.
Реальный ЕГЭ 2019. Задание 35. Вариант 7.
Органическое вещество, массовая доля углерода в котором равна 40,68%, кислорода – 54,24%, при нагревании реагирует с водным раствором гидроксида натрия, образуя метанол и соль органической кислоты. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции исходного вещества с водным раствором гидроксида натрия.
Реальный ЕГЭ 2019. Задание 35. Вариант 8.
Органическое вещество содержит 2,47% водорода, 29,63% углерода, 39,5% кислорода и 28,4% натрия по массе. Известно, что при нагревании этого вещества с избытком гидроксида натрия образуется предельный углеводород. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции, протекающей при нагревании исходного вещества с избытком гидроксида натрия.
Реальный ЕГЭ 2019. Задание 35. Вариант 9.
При нагревании с водным раствором гидроксида натрия некоторое органические вещество подвергается гидролизу с образованием двух продуктов, первый из которых имеет состав С2H3O2Na. Второй продукт гидролиза содержит 38,71% углерода и 9,68% водорода по массе. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции гидролиза исходного вещества в растворе гидроксида калия.
Реальный ЕГЭ 2019. Задание 35. Вариант 10.
При сжигании образца органического вещества массой 8,76 г получено 8,064 л (н.у.) углекислого газа и 5,4 г воды. При нагревании в присутствии кислоты данное вещество подвергается гидролизу с образованием двух продуктов в соотношении 2 : 1, первый из которых имеет состав С2H4O2. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества; 2) запишите молекулярную формулу исходного органического вещества; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции гидролиза исходного вещества в кислой среде.
Реальный ЕГЭ 2019. Задание 35. Вариант 11.
При взаимодействии соли вторичного амина с ацетатом серебра образуется органическое вещество А и бромид серебра. Вещество А содержит 11,76% азота, 26,89% кислорода и 10,92% водорода по массе. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества А; 2) запишите молекулярную формулу органического вещества А; 3) составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле; 4) напишите уравнение реакции получения вещества А взаимодействием соли вторичного амина и ацетата серебра.
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 1.
При взаимодействии соли первичного амина с ацетатом серебра образуется органическое вещество А и хлорид серебра. Вещество А содержит 15,38% азота, 35,16% кислорода и 9,90% водорода по массе. Напишите уравнение реакции получения вещества А взаимодействием соли первичного амина и ацетата серебра.
Развернуть/свернуть решениеМассовая доля углерода в веществе А составляет 100% — 15,38% — 35,16% — 9,9% = 39,56%
Найдем соотношение химических количеств углерода, водорода, азота и кислорода.
Примем массу соединения А за 100 г, тогда m (C) = 39,56 г, m (H) = 9,9 г, m (N) = 15,38 г, m (O) = 35,16 г, а химические количества элементов следующие:
n(С) = 39,56 г / 12 г/моль = 3,3 моль
n(H) = 9,9 г / 1 г / моль = 9,9 моль
n(N) = 15,38 г / 14 г/моль = 1,1 моль
n(О) = 35,16 г / 16 г/моль = 2,2 моль
Соотношение химических количеств углерода к водороду к азоту и к кислороду, как 3,3 : 9,9 : 1,1 : 2,2 = 3 : 9 : 1 : 2. Следовательно, молекулярная формула вещества А – C3H9NO2.
Так как вещество А получено из соли первичного амина по реакции с ацетатом серебра, то в его состав входит ацетат ион CH3COO—, значит на остаток (катион) первичного амина приходится СH6N (C3H9NO2 – C2H3O2).
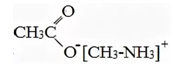
Структурная формула вещества А:
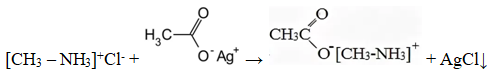
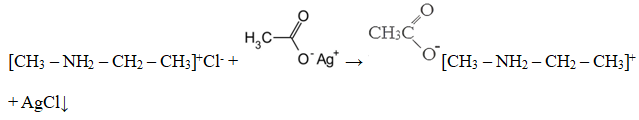
Уравнение реакции, описанной в условии задачи:
Также допускается запись:
[CH3 – NH3]+Cl— + CH3COOAg → [CH3 – NH3]+ CH3COO— + AgCl↓
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 2.
При сжигании образца органического вещества массой 9,52 г получено 24,64 г углекислого газа и 5,04 г воды. Данное вещество подвергается гидролизу под действием гидроксида натрия с образованием двух солей. Напишите уравнение гидролиза данного вещества в присутствии гидроксида натрия.
Развернуть/свернуть решениеИсходное органическое вещество точно содержит в своём составе углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M
M(CO2) = 44 г/моль, М(Н2О) = 18 г/моль
n (CO2) = 24,64 г/44 г/моль = 0,56 моль
n (С) = n (СО2) = 0,56 моль
m (C) = 0,56 моль ∙ 12 г/моль = 6,72 г
n (H2O) = 5,04 г / 18 г/моль = 0,28 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,28 моль = 0,56 моль
m (H) = 0,56 моль ∙ 1 г/моль = 0,56 г
m (C) + m (H) = 6, 72 г + 0,56 г = 7,28 г, что НЕ равно массе исходного вещества, а значит там есть кислород.
m (O) = m (в-ва) – m (C+H) = 9,52 г – 7,28 г = 2,24 г
n (O) = 2,24 г / 16 г/моль = 0,14 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 0,56 : 0,56 : 0,14 = 4 : 4 : 1
Следовательно простейшая формула вещества: C4H4O.
Щелочному гидролизу с образованием солей, как правило, подвергаются вещества, содержащие сложноэфирные связи. Поэтому предполагаем, что исходное органическое соединение – это сложный эфир. Но в сложных эфирах должно быть как минимум два атома кислорода, поэтому необходимо удвоить индексы в простейшей формуле.
Значит молекулярная формула вещества: C8H8O2.
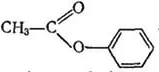
Но так как образуются две соли, а не одна, то можно предположить, что этот эфир ообразован не остатком спирта и карбоновой кислоты, а остатком фенола и карбоновой кислоты.
Значит структурная формула вещества:
Уравнение реакции, описанной в условии задачи:
CH3COOC6H5 + 2NaOH ↔ CH3COONa + C6H5ONa + H2O
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 3.
При сгорании 21,6 г органического вещества нециклического строения получили 70,4 г углекислого газа и 21,6 г воды. Известно, что при присоединении 1 моль хлороводорода к 1 моль этого вещества преимущественно образуется соединение, содержащее атом хлора у первичного атома углерода. Напишите уравнение реакции данного вещества с хлороводородом.
Развернуть/свернуть решениеИсходное органическое вещество точно содержит в своём составе углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M
M(CO2) = 44 г/моль, М(Н2О) = 18 г/моль
n (CO2) = 70,4 г/44 г/моль = 1,6 моль
n (С) = n (СО2) = 1,6 моль
m (C) = 1,6 моль ∙ 12 г/моль = 19,2 г
n (H2O) = 21,6 г / 18 г/моль = 1,2 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 1,2 моль = 2,4 моль
m (H) = 2,4 моль ∙ 1 г/моль = 2,4 г
m (C) + m (H) = 19,2 г + 2,4 г = 21,6 г, что и равно массе исходного вещества, а значит кислорода нет.
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) = 1,6 : 2,4 = 1 : 1,5 = 2 : 3
Следовательно простейшая формула вещества: C2H3.
Но вещества с такой формулой не существует (убедиться в этом вы можете попробовав нарисовать структурную формулу и тогда у углерода не будет соблюдаться валентность IV).
Значит индексы в простейшей формуле ещё раз надо удвоить.
Следовательно молекулярная формула вещества: C4H6.
Что соответствует углеводородам с общей формулой CnH2n-2. А значит это может быть алкин или алкадиен (циклические соединения не рассматриваем, так как в условии задачи сказано, что строение нециклическое). Но если предположить, что это бутин, то по правилу Марковникова при присоединении к 1 моль бутина 1 моль хлороводорода будет образовываться 2-хлорбутен-1 или 2-хлорбутен-2, т.е. хлор будет находиться у вторичного атома углерода, что НЕ соответствует условию задачи.
Значит делаем вывод, что исхлдное органическое вещество – это бутадиен. Но так как надо получить продукт, содержащий атом хлора у первичного атома, делаем вывод, что диен должен быть сопряжённый, так как только у сопряжённого бутадиена-1,3 преимущественно наблюдается 1,4-присоединение (при соотношении 1 моль бутадиена-1,3 и 1 моль хлороводорода).
Следовательно структурная формула исходного вещества:
СН2 = СН – СН = СН2
Уравнение реакции, описанной в условии задачи:
СН2 = СН – СН = СН2 + HCl → CH2Cl – CH = CH – CH3
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 4.
При взаимодействии соли вторичного амина с ацетатом серебра образуется органическое вещество А и йодид серебра. Вещество А содержит 45,71% углерода, 10,48% водорода и 30,48% кислорода по массе. Напишите уравнение реакции получения вещества А взаимодействием соли вторичного амина и ацетата серебра.
Развернуть/свернуть решениеВ веществе А также есть атомы азота, так как оно получилось из соли амина, в состав которого входил азот.
Массовая доля азота в веществе А составляет 100% — 45,71% — 10,48% — 30,48% = 13,33%
Найдем соотношение химических количеств углерода, водорода, азота и кислорода.
Примем массу соединения А за 100 г, тогда m (C) = 45,71 г, m (H) = 10,48 г, m (N) = 13,33 г, m (O) = 30,48 г, а химические количества элементов следующие:
n(С) = 45,71 г / 12 г/моль = 3,81 моль
n(H) = 10,48 г / 1 г / моль = 10,48 моль
n(N) = 13,33 г / 14 г/моль = 0,95 моль
n(О) = 30,48 г / 16 г/моль = 1,905 моль
Соотношение химических количеств углерода к водороду к азоту и к кислороду, как 3,81 : 10,48 : 0,95 : 1,905 = 4 : 11 : 1 : 2. Следовательно, молекулярная формула вещества А – C4H11NO2.
Так как вещество А получено из соли вторичного амина по реакции с ацетатом серебра, то в его состав входит ацетат ион CH3COO—, значит на остаток (катион) вторичного амина приходится С2H8N (C4H11NO2 – C2H3O2).
Структурная формула вещества А:
Уравнение реакции, описанной в условии задачи:
Также допускается запись:
[CH3 – NH2 – СН3]+I— + CH3COOAg → [CH3 – NH2 – СН3]+CH3COO— + AgI↓
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 5.
При сжигании образца органического вещества массой 16,32 г получено 21,5 л (н.у.) углекислого газа и 8,64 г воды. Данное вещество подвергается гидролизу под действием гидроксида калия с образованием двух солей. Напишите уравнение гидролиза данного вещества в присутствии гидроксида калия.
Развернуть/свернуть решениеИсходное органическое вещество точно содержит в своём составе углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M, n = V/Vm.
n (CO2) = 21,5 л/22,4 л/моль = 0,96 моль
n (С) = n (СО2) = 0,96 моль
m (C) = 0,96 моль ∙ 12 г/моль = 11,52г
n (H2O) = 8,64 г / 18 г/моль = 0,48 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,48 моль = 0,96 моль
m (H) = 0,96 моль ∙ 1 г/моль = 0,96 г
m (C) + m (H) = 11,52 г + 0,96 г = 12,48 г, что НЕ равно массе исходного вещества, а значит там есть кислород.
m (O) = m (в-ва) – m (C+H) = 16,32 г – 12,48 г = 3,84 г
n (O) = 3,84 г / 16 г/моль = 0,24 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 0,96 : 0,96 : 0,24 = 4 : 4 : 1
Следовательно простейшая формула вещества: C4H4O.
Щелочному гидролизу с образованием солей, как правило, подвергаются вещества, содержащие сложноэфирные связи. Поэтому предполагаем, что исходное органическое соединение – это сложный эфир. Но в сложных эфирах должно быть как минимум два атома кислорода, поэтому необходимо удвоить индексы в простейшей формуле.
Значит молекулярная формула вещества: C8H8O2.
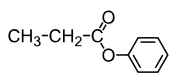
Но так как образуются две соли, а не одна, то можно предположить, что этот эфир ообразован не остатком спирта и карбоновой кислоты, а остатком фенола и карбоновой кислоты.
Значит структурная формула вещества:
Уравнение реакции, описанной в условии задачи:
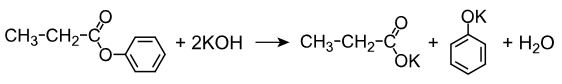
CH3COOC6H5 + 2KOH ↔ CH3COOK + C6H5OK + H2O
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 6.
При взаимодействии соли вторичного амина с ацетатом серебра образуется органическое вещество А и хлорид серебра. Вещество А содержит 50,43% углерода, 11,76% азота и 26,89% кислорода по массе. Напишите уравнение реакции получения вещества А взаимодействием соли вторичного амина и ацетата серебра.
Развернуть/свернуть решениеВ веществе А также есть атомы водорода, так как водород входит в состав всех органических веществ.
Массовая доля азота в веществе А составляет 100% — 50,43% — 11,76% — 26,88% = 10,93%
Найдем соотношение химических количеств углерода, водорода, азота и кислорода.
Примем массу соединения А за 100 г, тогда m (C) = 50,43 г, m (H) = 10,93 г, m (N) = 11,76 г, m (O) = 26,89 г, а химические количества элементов следующие:
n(С) = 50,43 г / 12 г/моль = 4,2 моль
n(H) = 10,93 г / 1 г / моль = 10,93 моль
n(N) = 11,76 г / 14 г/моль = 0,84 моль
n(О) = 26,89 г / 16 г/моль = 1,68 моль
Соотношение химических количеств углерода к водороду к азоту и к кислороду, как 4,2 : 10,93 : 0,84 : 1,68 = 5 : 13 : 1 : 2. Следовательно, молекулярная формула вещества А – C5H13NO2.
Так как вещество А получено из соли вторичного амина по реакции с ацетатом серебра, то в его состав входит ацетат ион CH3COO—, значит на остаток (катион) вторичного амина приходится С3H10N (C5H13NO2 – C2H3O2).
Структурная формула вещества А:
Уравнение реакции, описанной в условии задачи:
Также допускается запись:
[CH3 – NH2 – СН2 – СН3]+Cl— + CH3COOAg → [CH3 – NH2 – СН2 – СН3]+CH3COO— + AgCl↓
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 7.
При сжигании образца органического вещества А получено 4,48 л (н.у.) углекислого газа, 1,44 г воды и 12,96 г бромоводорода. Данное вещество А может быть получено присоединением избытка брома к соответствующему углеводороду Б. Также известно, что при бромировании этого углеводорода Б в условиях недостатка брома возможно образование структурных изомеров. Напишите уравнение реакции получения данного вещества А взаимодействием соответствующего углеводорода Б с избытком брома.
Развернуть/свернуть решениеn (CO2) = V (CO2) / Vm = 4,48 л / 22,4 л/моль = 0,2 моль
n (C) = n (CO2) = 0,2 моль.
n (H2O) = m (H2O) / M (H2O) = 1,44 г / 18 г/моль = 0,08 моль.
n (HBr) = m (HBr) / M (HBr) = 12,96 г / 81 г/моль = 0,16 моль, тогда:
n (H) = 2 ∙ n (H2O) + n (HBr) = 2∙0,08 + 0,16 = 0,32 моль
n (Br) = n (HBr) = 0,16 моль.
Поскольку вещество А может быть получено присоединением брома к углеводороду Б, очевидно, что вещество А кислород не содержит и его общая формула может быть записана как CxHyBrz. Тогда:
x : y : z = 0,2 : 0,32 : 0,16 = 1,25 : 2 : 1 = 5 : 8 : 4
Таким образом, молекулярная формула вещества А – C5H8Br4.
В таком случае исходный углеводород Б, очевидно, имеет формулу C5H8.
Данная молекулярная формула вписывается в гомологический ряд соединений с общей формулой CnH2n-2.
Такую формулу могут иметь алкины и алкадиены. Вариант с алкином отпадает, т.к. при частичном бромировании алкинов образование структурных изомеров невозможно.
Таким образом, наиболее вероятен в качестве решения алкадиен. При этом одновременно подходят три алкадиена:
пентадиен-1,4: CH2=CH-CH2-СН=СН2
пентадиен-1,3: CH2=CH-CH=CH-СН3
пентадиен-1,2: CH2=C=CH-CH2-СН3
По всей видимости, авторы задания подразумевали все-таки пентадиен-1,3, способный к 1,2- и 1,4-присоединению при взаимодействии с галогеном в соотношении 1:1.
В таком случае уравнение получения вещества А присоединением избытка брома к соответствующему углеводороду будет иметь вид:
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 8.
При сжигании образца органического вещества массой 12 г получено 31,68 г углекислого газа и 7,2 г воды. Данное вещество подвергается гидролизу под действием гидроксида калия с образованием двух солей. Напишите уравнение гидролиза данного вещества в присутствии гидроксида калия.
Развернуть/свернуть решениеИсходное органическое вещество точно содержит в своём составе углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M
M(CO2) = 44 г/моль, М(Н2О) = 18 г/моль
n (CO2) = 31,68 г/44 г/моль = 0,72 моль
n (С) = n (СО2) = 0,72 моль
m (C) = 0,72 моль ∙ 12 г/моль = 8,64 г
n (H2O) = 7,2 г / 18 г/моль = 0,4 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,4 моль = 0,8 моль
m (H) = 0,8 моль ∙ 1 г/моль = 0,8 г
m (C) + m (H) = 8,64 г + 0,8 г = 9,44 г, что НЕ равно массе исходного вещества, а значит там есть кислород.
m (O) = m (в-ва) – m (C+H) = 12 г – 9,44 г = 2,56 г
n (O) = 2,56 г / 16 г/моль = 0,16 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 0,72 : 0,8 : 0,16 = 4,5 : 5 : 1 = 9 : 10 : 2
Значит молекулярная формула вещества: C9H10O2.
Но так как образуются две соли, а не одна, то можно предположить, что этот эфир ообразован не остатком спирта и карбоновой кислоты, а остатком фенола и карбоновой кислоты.
Значит структурная формула вещества:
Уравнение реакции, описанной в условии задачи:
Демо ЕГЭ 2019
Досрочный ЕГЭ 2019 (25 марта 2019)
Досрочный ЕГЭ 2019. Задание 35. При сжигании образца органического вещества массой 5,84 г получено 10,56 г углекислого газа и 3,6 г воды. При нагревании с водным раствором гидроксида калия данное вещество подвергается гидролизу с образованием двух продуктов, один из которых имеет состав С2H3O2K.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
- запишите молекулярную формулу органического вещества;
- составьте возможную структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции гидролиза исходного вещества в растворе гидроксида калия.
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку