Скачать Пробный вариант 7. ЕГЭ 2020 по химии с ответами в формате pdf
Вариант 7
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
1) Fe; 2) Zn; 3) Cu; 4) Cr; 5) K.
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
- Определите, атомы каких из указанных элементов в основном состоянии имеют конфигурацию внешнего электронного слоя ns2. Запишите в поле ответа номера выбранных элементов.
- Из указанных в ряду химических элементов выберите три элемента, атомы которых, согласно положению в Периодической системе химических элементов Д.И. Менделеева, имеют менее 28 протонов. Расположите выбранные элементы в порядке увеличения кислотных свойств, образуемых ими высших гидроксидов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
- Из числа указанных в ряду элементов выберите два элемента, валентность которых в оксидах может принимать значение I. Запишите в поле ответа номера выбранных элементов.
- Из предложенного перечня выберите два утверждения, которые верно характеризуют химические связи в молекуле воды.
1) энергии всех связей одинаковы
2) имеется двойная связь
3) образованы р-электронами водорода и кислорода
4) одна связь образована по донорно-акцепторному механизму
5) все связи ковалентные
Запишите в поле ответа номера выбранных утверждений.
- Установите соответствие между тривиальным названием вещества и его формулой: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ФОРМУЛА |
| А) мрамор | 1) HF |
| Б) питьевая сода | 2) Na2CO3 |
| В) плавиковая кислота | 3) NaHCO3 |
| 4) CaCO3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите две пары веществ, в которых каждое из веществ взаимодействует с хлором.
1) O2 и Ar
2) Fe и NaBr
3) N2 и O2
4) KF и P
5) H2 и F2
Запишите в поле ответа номера выбранных пар веществ.
- В одну из пробирок раствором хлорида магния добавили сильный электролит Х, а в другую – раствор слабого электролита Y. В результате в каждой из пробирок наблюдали образование белого осадка. Из предложенного перечня выберите вещества Х и Y, которые могут вступать в описанные реакции.
1) иодоводородная кислота
2) гидросульфит калия
3) плавиковая кислота
4) гидроксид натрия
5) уксусная кислота
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
- Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) S | 1) NH3, K2CO3, Ba(HSO3)2 |
| Б) HCl | 2) O2, NaOH, BaSO4 |
| В) FeS | 3) P, H2O, KOH |
| Г) CuS | 4) HBr, O2, HNO3 |
| 5) H2, O2, HNO3 (конц.) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между исходными веществами, вступающими в реакцию, и азотсодержащим продуктом, который образуется в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | АЗОТСОДЕРЖАЩИЙ ПРОДУКТ РЕАКЦИИ |
| А) Ba3N2 и HCl (p-p, изб.) | 1) NH3 |
| Б) Ba3N2 и H2O | 2) NH4Cl |
| В) Ba3N2 и Cl2 | 3) N2 |
| Г) NO2 и C | 4) NCl3 |
| 5) N2O5 | |
| 6) HNO2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) H2O
2) O2
3) Fe
4) CO2
5) HCl
Запишите в таблицу номера веществ под соответствующими буквами.
- Установите соответствие между структурной формулой вещества и общей формулой класса/группы органических соединений, к которому(-ой) оно принадлежит: к каждой позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
| СТРУКТУРНАЯ ФОРМУЛА ВЕЩЕСТВА | ОБЩАЯ ФОРМУЛА КЛАССА/ГРУППЫ |
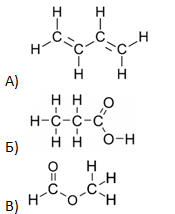 |
1) CnH2nO2
2) CnH2n-2O2 3) CnH2n 4) CnH2n-2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два вещества, молекулы которых содержат функциональную группу альдегидов.
1) метилформиат
2) пропилацетат
3) ацетальдегид
4) ацетон
5) диэтиловый эфир
Запишите в поле ответа номера выбранных веществ.
- Из предложенного перечня выберите два вещества, при взаимодействии каждого из которых с подкисленным раствором перманганата калия образуется карбоновая кислота.
1) C2H2
2) C6H6
3) C6H5CH3
4) CH3 – CH = CH – CH3
5) CH3 – CH2 – CH3
Запишите в поле ответов номера выбранных веществ.
- Из предложенного перечня выберите два вещества, с которыми реагирует гидроксид натрия.
1) этиловый спирт
2) фенол
3) этиловый эфир уксусной кислоты
4) этиленгликоль
5) формальдегид
Запишите в поле ответа номера выбранных веществ.
- Из предложенного перечня выберите два вещества, которые подвергаются гидролизу.
1) аланин
2) рибоза
3) фруктоза
4) крахмал
5) триолеат глицерина
Запишите в поле ответа номера выбранных веществ.
- Установите соответствие между схемой реакции и органическим веществом, преимущественно образующимся в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
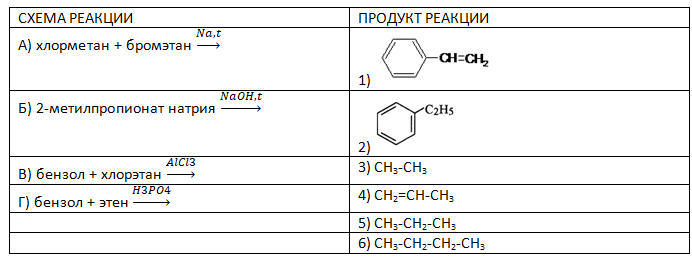 Запишите в таблицу выбранные цифры под соответствующими буквами.
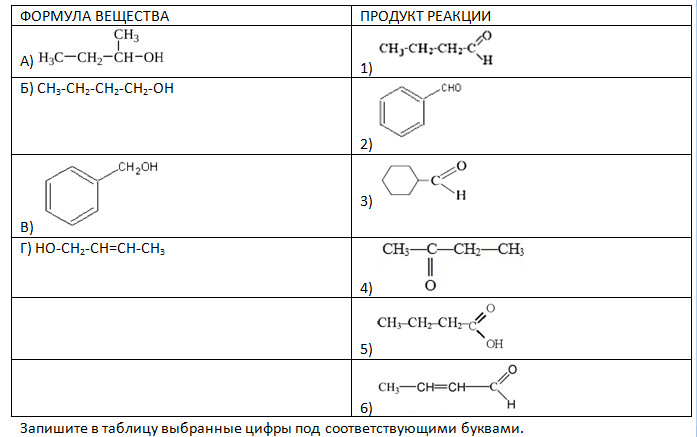
Запишите в таблицу выбранные цифры под соответствующими буквами. - Установите соответствие между формулой вещества и органическим продуктом реакции данного вещества с оксидом меди (II) при нагревании: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) CH3Cl
2) CH4
3) C2H2
4) CH2Cl2
5) C2H2Cl2
Запишите в таблицу номера веществ под соответствующими буквами.
- Из предложенного перечня пар веществ выберите две пары, взаимодействие между которыми можно отнести к реакциям замещения.
1) этен и вода
2) хлор и водород
3) хлор и бутан
4) фенол и натрий
5) ацетат свинца (р-р) и серная кислота
Запишите в поле ответа номера выбранных пар веществ.
- Из предложенного перечня выберите два фактора, которые менее всего влияют на скорость коррозии цинкового ведра.
1) влажность
2) температура
3) присутствие в воздухе аргона
4) содержание в воздухе сернистого газа
5) контакт ведра с древесиной
Запишите в поле ответа номера выбранных факторов.
- Установите соответствие между типом добавляемого вещества, которое требуется для химического превращения, и схемой этого превращения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ТИП ДОБАВЛЯЕМОГО ВЕЩЕСТВА | СХЕМА ПРЕВРАЩЕНИЯ |
| А) окислитель | 1) HPO42- → H2PO4— |
| Б) восстановитель | 2) HS— → SO2 + H2O |
| В) не проявляет окислительно-восстановительных свойств | 3) NO3— → NO2— |
| 4) KClO3 → KCl + KClO4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества, если электроды инертные: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) AlCl3 | 1) металл, галоген |
| Б) NaOH | 2) основание, хлор, водород |
| В) Hg(NO3)2 | 3) металл, кислород |
| Г) AuCl3 | 4) водород, галоген |
| 5) водород, кислород | |
| 6) металл, кислота, кислород |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названием соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
| А) гипохлорит натрия | 1) гидролизуется по катиону |
| Б) сульфид меди (II) | 2) гидролизуется по аниону |
| В) силикат калия | 3) гидролизу не подвергается |
| Г) цианид аммония | 4) гидролизуется по катиону и аниону |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между схемой обратимой реакции и направлением смещения химического равновесия при увеличении давления: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) H2 (г) + O2 (г) ↔ H2O (г) | 1) смещается в сторону прямой реакции |
| Б) H2 (г) + Cl2 (г) ↔ HCl (г) | 2) смещается в сторону обратной реакции |
| В) N2 (г) + O2 (г) ↔ NO (г) | 3) практически не смещается |
| Г) N2O4 (г) ↔ NO (г) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между веществом, взятом в виде водного раствора, и реактивом, который можно использовать для качественного определения этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВА | РЕАКТИВ |
| А) концентрированная азотная кислота | 1) хлорид бария |
| Б) разбавленная серная кислота | 2) гидроксид натрия |
| В) нитрат магния | 3) серебро |
| Г) гидроксид калия | 4) сульфат меди (II) |
| 5) сульфат бария |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названием полимера и способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ПОЛИМЕРА | СПОСОБ ПОЛУЧЕНИЯ |
| А) крахмал | 1) полимеризация |
| Б) полиэтилен | 2) поликонденсация |
| В) бутадиенстирольный каучук | 3) этерификация |
| 4) гидрогенизация |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- К раствору KNO3 массой 75 г с w(KNO3) = 20% добавили некоторую массу раствора KNO3 c w(KNO3) = 50%. В конечном растворе w(KNO3) = 30%. Какова масса добавленного раствора KNO3? (Запишите число с точностью до десятых.)
- Какой объём водорода (в литрах) при пиролизе 1,5 л метана при температуре 1500С? Объёмы газов измерены в одинаковых условиях. (Запишите число с точностью до сотых.)
- Вычислите массу кислорода (в граммах), выделившегося при разложении 40,4 г нитрата калия. (Запишите число с точностью до десятых.)
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
серная кислота, перманганат калия, пероксид калия, ацетат цинка, сульфид меди (II), карбонат калия. Допустимо использование водных растворов веществ.
- Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора и выделением газа. Выделение осадка в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
- Из предложенного перечня веществ выберите два вещества, которые вступают в реакцию ионного обмена с образованием газа, который не поддерживает горение. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
- Дана бесцветная соль, которая окрашивает пламя спиртовки в фиолетовый цвет. При лёгком нагревании её с концентрированной серной кислотой отгоняется легкокипящая жидкость, в которой растворяется медь. Продуктами растворения являются соль и бурый газ. Раствор образовавшейся соли подвергают электролизу. А образовавшийся газ пропускают над натрием. Напишите уравнения четырёх описанных реакций.
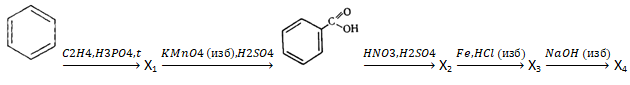
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
- Растворимость хлороводорода при н.у. равна 504 объёма на 1 объём воды. Приготовили 291,4 г насыщенного раствора хлороводорода и разделили его на 3 колбы. В первую колбу добавили избыток раствора нитрата серебра (I) в результате чего образовался осадок массой 172,2 г. Раствор из второй колбы полностью нейтрализовали 250 мл раствора гидроксида натрия с массовой долей 20% и плотность 1,1 г/мл. В третью колбу добавили твердую пищевую соду массой 86,1 г. Рассчитайте массовую долю растворённого вещества в третьей колбе после полного завершения реакции. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических венличин).
- При сгорании 33,2 г органического вещества получили 35,84 л углекислого газа (н.у.) и 10,8 г воды. При нагревании данное вещество подвергается внутримолекулярной дегидратации. Также известно, что исходное вещество содержит две одинаковые функциональные группы и находятся они у соседних атомов углерода.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение внутримолекулярной дегидратации этого вещества при нагревании (используйте структурные формулы органических веществ).
Система оценивания экзаменационной работы по химии
Часть 1
За правильный ответ на каждое из заданий 1–6, 11–15, 19–21, 26–29 ставится 1 балл.
Задание считается выполненным верно, если экзаменуемый дал правильный ответ в виде последовательности цифр или числа с заданной степенью точности.
Задания 7–10, 16–18, 22–25 считаются выполненными верно, если правильно указана последовательность цифр.
За полный правильный ответ заданий 7–10, 16–18, 22–25 ставится 2 балла; если допущена одна ошибка – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
| Номер задания | Правильный ответ |
| 1 | 12 |
| 2 | 514 |
| 3 | 35 |
| 4 | 15 |
| 5 | 431 |
| 6 | 25 |
| 7 | 43 |
| 8 | 5145 |
| 9 | 2133 |
| 10 | 23 |
| 11 | 411 |
| 12 | 13 |
| 13 | 34 |
| 14 | 23 |
| 15 | 45 |
| 16 | 5522 |
| 17 | 4126 |
| 18 | 21 |
| 19 | 34 |
| 20 | 35 |
| 21 | 231 |
| 22 | 2561 |
| 23 | 2324 |
| 24 | 1332 |
| 25 | 3124 |
| 26 | 211 |
| 27 | 37,5 |
| 28 | 2,25 |
| 29 | 6,4 |
Часть 2
Критерии оценивания заданий с развёрнутым ответом
За выполнение заданий 30, 31 ставится от 0 до 2 баллов; задания 35 – от 0 до 3 баллов; заданий 32 и 34 – от 0 до 4 баллов; задания 33 – от 0 до 5 баллов.
Задание 30
Вариант ответа:
5K2O2 + 2KMnO4 + 8H2SO4 → 5O2↑ + 2MnSO4 + 6K2SO4 + 8H2O
2 Mn+7 + 5ē → Mn+2
5 2O-1 – 2ē → O20
Пероксид калия или кислород в степени окисления -1 является восстановителем.
Перманганат калия или марганец в степени окисления +7 – окислителем
Задание 31
Вариант ответа:
K2CO3 + H2SO4 = K2SO4 + H2O + CO2
2K+ + CO32- + 2H+ + SO42- = 2K+ + SO42- + H2O + CO2
2H+ + CO32- = CO2 + H2O
Задание 32
Вариант ответа:
KNO3 (тв) + H2SO4 (конц) = KHSO4 + HNO3↑ (при слабом нагревании)
Cu + 4HNO3 (конц) = Cu(NO3)2 + 2NO2 + 2H2O
2Cu(NO3)2 + 2H2O = 2Cu + 4HNO3 + O2 (электролиз)
2Na + O2 = Na2O2
Задание 33
Примечание. Допустимо использование структурных формул разного вида (развёрнутой, сокращённой, скелетной), однозначно отражающих порядок связи атомов и взаимное расположение заместителей и функциональных групп в молекуле органического вещества.
Задание 34
Объяснение этой задачи вы можете найти на Ютуб по ссылке
Ответ: 48,4%
Задание 35
Исходное органическое вещество точно содержит в своём составе углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M, n = V/Vm.
n (CO2) = 35,84 л/22,4 л/моль = 1,6 моль
n (С) = n (СО2) = 1,6 моль
m (C) = 1,6 моль ∙ 12 г/моль = 19,2 г
n (H2O) = 10,8 г / 18 г/моль = 0,6 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,6 моль = 1,2 моль
m (H) = 1,2 моль ∙ 1 г/моль = 1,2 г
m (C) + m (H) = 19,2 г + 1,2 г = 20,4 г, что НЕ равно массе исходного вещества, а значит там есть кислород.
m (O) = m (в-ва) – m (C+H) = 33,2 г – 20,4 г = 12,8 г
n (O) = 12,8 г / 16 г/моль = 0,8 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 1,6 : 1,2 : 0,8 = 4 : 3 : 2
Следовательно простейшая формула вещества: C4H3O2.
Попытки составить структурную формулу, удовлетворяющие условию задания с полученной простейшей формулой, не увенчаются успехом. Либо вещества будут неустойчивыми. Поэтому надо удвоить простейшую формулу.
Молекулярная формула C8H6O2.
Также вы можете скачать:
- Пробный вариант №1 ЕГЭ 2020 г. (аналог демонстрационного варианта ЕГЭ 2020 г.) с ответами в формате pdf
- Пробный вариант 2. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 3. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 4. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 5. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 6. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 7. ЕГЭ 2020 по химии с ответами в формате pdf
- Демонстрационный вариант ЕГЭ 2020 (с сайта ФИПИ)
- Кодификатор ЕГЭ 2020 (с сайта ФИПИ)
- Спецификация ЕГЭ 2020 (с сайта ФИПИ)
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку

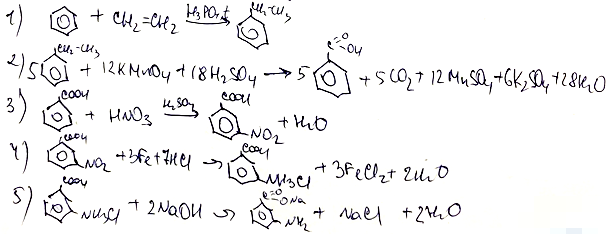
Рассмотрите пожалуйста задания :
12)- у альдегидов и кетонов одинаковая функциональная группа, не может быть ответом 13. Я считаю ответ 34(тк альдегид и кетон)
22) При электролизе на катоде Алюминий не будет металлом, выделится водород!!
Пожалуйста, исправьте меня, если я буду неправа.С уважением.
Здравствуйте. В задании 12 нет ошибки, так как в метилформиате остаток муравьиной кислоты содержит альдегидную группу CHO, а в кетоне этой группы нет.
В задании 22 вы правы, опечатку уже исправил. Спасибо, что помогаете делать мои тесты лучше!
Вопрос к 22, в пункте B написано,что выделяется водород металл и Кислота. Но в задании пишется о продуктах на ЭЛЕКТРОДАХ, а ведь на электродах не выделяется кислота, она в растворе. Почему ?
Здравствуйте. Очень хороший комментарий. И вы абсолютно правы, что кислота не образуется на электродах, а находится в диссоциированном виде (в виде ионов) в растворе. Поэтому я изменю условие так, чтобы не было неточности. Спасибо!
и можно ли в 33 вместо одной нитрогруппы в 4 реакции написать 2 радикала ?( не только у 3 атома углерода в кольце,но и у 5)?
Здравствуйте. В принципе, можно, так как карбоксильная группа является ориентантом второго рода, что приводит к повышению электронной плотности в мета-положениях (3 и 5 атомы углерода). НО, как правило, в таких уравнениях по умолчанию мы пишем заместитель только у третьего атома углерода. Поэтому моя рекомендация: на ЕГЭ писать заместитель только в одном мета-положении, если нет никаких дополнений в условии. А вот если над стрелочной написано, например, 2 моль азотной кислоты на 1 моль бензойной кислоты, то тогда следует писать заместитель и у третьего, и у пятого атома углерода.