Скачать Пробный вариант 6. ЕГЭ 2020 по химии с ответами в формате pdf
Вариант 6
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
1) Cr; 2) Fe; 3) As; 4) N; 5) P.
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
- Определите, атомы каких из указанных элементов в основном состоянии имеют спаренные электроны на 3d-подуровне. Запишите в поле ответа номера выбранных элементов.
- Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе. Расположите выбранные элементы в порядке увеличения устойчивости, образуемых ими летучих водородных соединений. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
- Из числа указанных в ряду элементов выберите два элемента с наибольшей электроотрицательностью. Запишите в поле ответа номера выбранных элементов.
- Из предложенного перечня выберите два вещества с наиболее высокой температурой кипения:
1) F2
2) HF
3) H2O
4) Cl2
5) HCl
Запишите в поле ответа номера выбранных веществ.
- Установите соответствие между классом неорганического вещества и его формулой: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| КЛАСС ВЕЩЕСТВА | ФОРМУЛА |
| А) соли | 1) HCN |
| Б) оксиды | 2) LiOH |
| В) кислоты | 3) Cl2O |
| 4) Na2[Zn(OH)4] |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два вещества, с каждым из которых НЕ взаимодействует азот, в отличие от фосфора.
1) H2
2) O2
3) Na
4) Cl2
5) S
Запишите в поле ответа номера выбранных веществ.
- В одну из пробирок с с раствором, образованным при взаимодействии хлорида алюминия с избытком гидроксида калия, добавили избыток сильной кислоты Х, а в другую – избыток раствора вещества Y. В результате в первой пробирке протекала реакция, которая не имеет видимых признаков, а во второй пробирке наблюдали выпадение осадка. Из предложенного перечня выберите вещества Х и Y, которые могут вступать в описанные реакции.
1) сероводородная кислота
2) азотная кислота
3) аммиак
4) гидроксид натрия
5) сульфат калия
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
- Установите соответствие между схемами превращений и формулами веществ, необходимых для их последовательного осуществления: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМЫ ПРЕВРАЩЕНИЙ | ФОРМУЛЫ ВЕЩЕСТВ |
| А) Fe → Fe(NO3)3 → Fe → FeCl2 | 1) HNO3, Al, HCl |
| Б) C → CaC2 → Ca(OH)2 → CaSiO3 | 2) Ca, H2O, O2 |
| В) Si → Ca2Si → Ca(OH)2 → Ca(NO3)2 | 3) HNO3, Al, Cl2 |
| Г) Si → Ca2Si → SiH4 → SiO2 | 4) Ca, H2O, HNO3 |
| 5) Ca, H2O, SiO2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
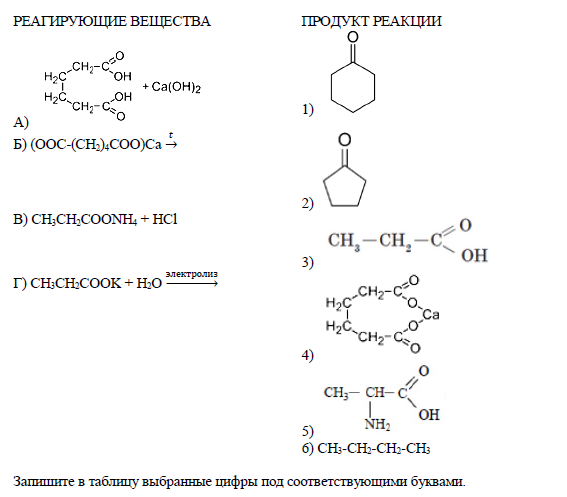
- Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) Al и H2SO4 (p-p) | 1) Al(OH)3 и NH4NO3 |
| Б) Al(NO3)3 и K2S (p-p) | 2) Al(OH)3, H2S и KNO3 |
| В) Al(OH)3 и H2SO4 (p-p) | 3) Al2S3 и KNO3 |
| Г) Al(NO3)3 и NH3 (p-p) | 4) NH4[Al(OH)4] и NH4NO3 |
| 5) Al2(SO4)3 и H2O | |
| 6) Al2(SO4)3 и H2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) KCl
2) KClO4
3) KNO2
4) NO2
5) KClO3
Запишите в таблицу номера веществ под соответствующими буквами.
- Установите соответствие между масштабной моделью молекулы и её названием: к каждой позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
| МАСШТАБНАЯ МОДЕЛЬ МОЛЕКУЛЫ | НАЗВАНИЕ ВЕЩЕСТВА |
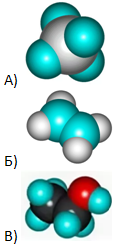 |
1) этен
2) этин 3) метан 4) этанол |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два вещества, которые являются изомерами масляной кислоты.
1) бутанол
2) пентановая кислота
3) бутаналь
4) 2-метилпропановая кислота
5) этилацетат
Запишите в поле ответа номера выбранных веществ.
- Из предложенного перечня выберите два вещества, каждое из которых может реагировать с каждым из веществ ряда – H2O, HBr, H2.
1) этан
2) бутен-2
3) бутан
4) хлорэтан
5) ацетилен
Запишите в поле ответов номера выбранных веществ.
- Из предложенного перечня выберите два вещества, водные растворы которых НЕ реагируют с гидроксидом меди (II).
1) этандиол-1,2
2) уксусная кислота
3) пропанол-1
4) метилацетат
5) пропионовый альдегид
Запишите в поле ответа номера выбранных веществ.
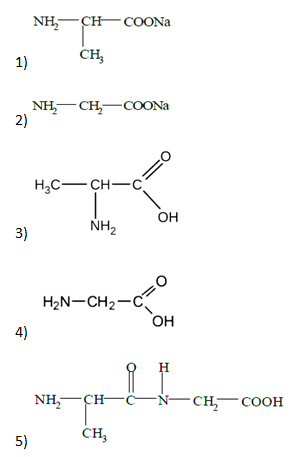
- Из предложенного перечня продуктов, выберите два, которые образуются при щелочном гидролизе дипептида, состоящего из остатков аланина и глицина.
Запишите в поле ответа номера выбранных продуктов.
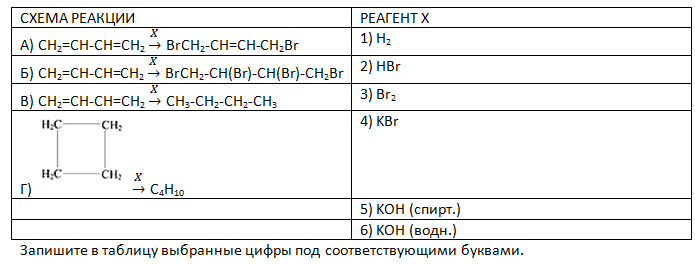
- Установите соответствие между схемой реакции и реагентом Х, который участвует в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Установите соответствие между реагирующими веществами и органическим веществом-продуктом реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) C2H6
2) CO2
3) C4H8O2
4) C2H4O2
5) C4H10
Запишите в таблицу номера веществ под соответствующими буквами.
- Из предложенного перечня типов реакций выберите два типа реакций, к которым можно отнести взаимодействие хлорэтана со спиртовым раствором гидроксида калия.
1) обмена
2) отщепления
3) соединения
4) окислительно-восстановительная
5) гомогенная
Запишите в поле ответа номера выбранных типов реакций.
- Из предложенного перечня выберите два вещества, реакция между которыми протекает с наибольшей скоростью.
1) AgNO3(р-р) и NaCl(р-р)
2) CaCO3 и HCl(р-р)
3) Zn и H2SO4
4) Mg и О2
5) CuCl2(р-р) и K2S(р-р)
Запишите в поле ответа номера выбранных веществ.
- Установите соответствие между рядом части и изменением их окислительно-восстановительных свойств: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЯД ЧАСТИЦ | ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА |
| А) Na+ → Fe3+ → Cu2+ | 1) усиливаются восстановительные свойства |
| Б) Se → S8 → O2 | 2) усиливаются окислительные свойства |
| В) S → H2S → SO42- | 3) окислительно-восстановительные свойства не изменяются |
| 4) восстановительные свойства усиливаются, а затем ослабевают |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного раствора (электроды инертные): каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ПРОДУКТ НА КАТОДЕ |
| А) Mg(NO3)2 | 1) водород |
| Б) AgNO3 | 2) магний |
| В) Cu(NO3)2 | 3) серебро |
| Г) Ba(NO3)2 | 4) медь |
| 5) кислород | |
| 6) барий |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названием соли и цветом метилоранжа, в который окрашивает его водный раствор этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | ЦВЕТ МЕТИЛОРАНЖА |
| А) гидрофосфат натрия | 1) красный |
| Б) нитрат кальция | 2) жёлтый |
| В) карбонат рубидия | 3) оранжевый |
| Г) сульфат железа (III) | 4) малиновый |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между уравнением обратимой реакции и направлением смещения химического равновесия при увеличении давления: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) H2O (ж) + C (тв) ↔ CO (г) + H2 (г) – Q | 1) смещается в сторону прямой реакции |
| Б) H2 (г) + I2 (г) ↔ 2HI (г) – Q | 2) смещается в сторону обратной реакции |
| В) I2 (г) + Cl2 (г) ↔ 2ICl (г) + Q | 3) практически не смещается |
| Г) 2H2 (г) + O2 (г) ↔ 2H2O (ж) + Q |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между формулой вещества, взятого в виде водного раствора, и формулой реагента, который можно использовать для качественного определения этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТ |
| А) NaI | 1) KOH |
| Б) NaCl | 2) KHCO3 |
| В) NaF | 3) CH3COONa |
| Г) BaCl2 | 4) AgNO3 |
| 5) Mg(HCO3)2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между продуктами коксования каменного угля и и веществами, которые можно из них получить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ПРОДУКТ КОКСОВАНИЯ КАМЕННОГО УГЛЯ | ПОЛУЧАЕМОЕ ВЕЩЕСТВО |
| А) каменно-угольная смола | 1) аммиак |
| Б) аммиачная вода | 2) водород |
| В) коксовый газ | 3) этилен |
| 4) бензол |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Вычислите массовую долю хлората калия в насыщенном водном растворе при 10С, если растворимость этой соли при данной температуре составляет 40,8 ммоль на 100 г воды. (Запишите число с точностью до сотых.)
- Сгорание бензола количеством вещества 1 моль сопровождается выделением 3301,2 кДж теплоты. Какое количество теплоты (в кДж) выделяется при горении бензола массой 19,5 г? (Запишите число с точностью до десятых.)
- Какую массу фосфора (в граммах) надо сжечь для получения его высшего оксида массой 7,1 г. (Запишите число с точностью до десятых.)
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
сульфат свинца (II), иодид калия, хлорид цинка, озон, карбонат калия, гидроксид алюминия. Допустимо использование водных растворов веществ.
- Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием осадка (окрашивание раствора) и выделением газа. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
- Из предложенного перечня веществ выберите вещества, которые вступают в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
- Две соли содержат одинаковый катион. Термическое разложение первой из них напоминает извержение вулкана, при этом выделяется малоактивный бесцветный газ, входящий в состав воздуха, и образуется вещество зелёного цвета. При взаимодействии второй соли с раствором нитрата серебра (I) образуется белый творожистый осадок, а при нагревании этой соли с гидроксидом кальция образуется бесцветный ядовитый газ с резким запахом. При пропускании этого газа при нагревании над оксидом меди образуется газ, который выделялся при разложении первой соли. Напишите уравнения четырёх описанных реакций.
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
- Через 22,4 л смеси водорода, кислорода и хлора (н.у.) пропустили электрический разряд. После охлаждения продуктов реакции в сосуде обнаружили газ и жидкость. На нейтрализацию жидкости пошло 1,6 г гидроксида натрия. Оставшийся в сосуде после реакции газ полностью прореагировал с нагретым оксидом меди (II), причём масса последнего уменьшилась на 0,96 г. Определите массовую долю растворённого вещества в жидкости, полученной после пропускания электрического разряда через исходную газовую смесь. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических венличин).
- Неизвестное органическое вещество содержит 60% углерода, 5% водорода и 35% азота по массе. Относительная плотность паров этого вещества по водороду равна 40. Это вещество можно отнести к производным циановодородной кислоты и алкана. А получить его можно нагреванием дибромалкана с цианидом калия.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение получения исходного органического соединения нагреванием дибромалкана с цианидом калия (используйте структурные формулы органических веществ).
Система оценивания экзаменационной работы по химии
Часть 1
За правильный ответ на каждое из заданий 1–6, 11–15, 19–21, 26–29 ставится 1 балл.
Задание считается выполненным верно, если экзаменуемый дал правильный ответ в виде последовательности цифр или числа с заданной степенью точности.
Задания 7–10, 16–18, 22–25 считаются выполненными верно, если правильно указана последовательность цифр.
За полный правильный ответ заданий 7–10, 16–18, 22–25 ставится 2 балла; если допущена одна ошибка – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
| Номер задания | Правильный ответ |
| 1 | 23 |
| 2 | 354 |
| 3 | 45 |
| 4 | 23 |
| 5 | 431 |
| 6 | 45 |
| 7 | 21 |
| 8 | 1542 |
| 9 | 6251 |
| 10 | 53 |
| 11 | 314 |
| 12 | 45 |
| 13 | 25 |
| 14 | 34 |
| 15 | 12 |
| 16 | 3311 |
| 17 | 4236 |
| 18 | 54 |
| 19 | 24 |
| 20 | 15 |
| 21 | 224 |
| 22 | 1341 |
| 23 | 2321 |
| 24 | 2331 |
| 25 | 4454 |
| 26 | 413 |
| 27 | 4,76 |
| 28 | 825,3 |
| 29 | 3,1 |
Часть 2
Критерии оценивания заданий с развёрнутым ответом
За выполнение заданий 30, 31 ставится от 0 до 2 баллов; задания 35 – от 0 до 3 баллов; заданий 32 и 34 – от 0 до 4 баллов; задания 33 – от 0 до 5 баллов.
Задание 30
Вариант ответа:
2KI + O3 + H2O → 2KOH + O2↑ + I2↓
1 O0 + 2ē → O-2
1 2I— – 2ē → I20
Иодид калия или иод в степени окисления -1 является восстановителем.
Озон – окислителем
Задание 31
Вариант ответа:
ZnCl2 + K2CO3 = ZnCO3 + 2KCl
Zn2+ + 2Cl— + 2K+ + CO32- = ZnCO3 + 2K+ + 2Cl—
Zn2+ + CO32- = ZnCO3
Задание 32
Вариант ответа:
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
NH4Cl + AgNO3 = NH4NO3 + AgCl
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O
2NH3 + 3CuO = 3Cu + N2 + 3H2O
Задание 33
Примечание. Допустимо использование структурных формул разного вида (развёрнутой, сокращённой, скелетной), однозначно отражающих порядок связи атомов и взаимное расположение заместителей и функциональных групп в молекуле органического вещества.
Задание 34
Объяснение этой задачи вы можете найти на Ютуб по ссылке
Ответ: 11,9%
Задание 35
Найдем соотношение количества вещества углерода, водорода и азота.
Примем массу соединения за 100 грамм, тогда количество вещества элементов следующее:
n(С) = 60 г/12 г/моль = 5 моль
n(N) = 35 г/14 г/моль = 2,5 моль
n(H) = 5 г/1 г/моль = 5 моль
Соотношение углерода к азоту и водороду 5 : 2,5 : 5 = 2 : 1 : 2
Простейшая формула C2H2N, М (C2H2N) = 40 г/моль
А по относительной плотности по водороду находим, что М (исходного вещества) = 2 г/моль ∙ 40 = 80 г/моль
Значит, простейшую формулу необходимо удвоить.
Молекулярная формула вещества C4H4N2
Так как исходное вещество является производным циановодородной кислоты, то там должна сохраняться структура кислотного остатка С≡N
Структурная формула N≡C – CH2 – CH2 – C≡N
Уравнение получения:
Br – CH2 – CH2 – Br + 2KCN N≡C – CH2 – CH2 – C≡N + 2KBr.
Также вы можете скачать:
- Пробный вариант №1 ЕГЭ 2020 г. (аналог демонстрационного варианта ЕГЭ 2020 г.) с ответами в формате pdf
- Пробный вариант 2. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 3. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 4. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 5. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 6. ЕГЭ 2020 по химии с ответами в формате pdf
- Демонстрационный вариант ЕГЭ 2020 (с сайта ФИПИ)
- Кодификатор ЕГЭ 2020 (с сайта ФИПИ)
- Спецификация ЕГЭ 2020 (с сайта ФИПИ)
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку

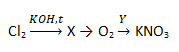
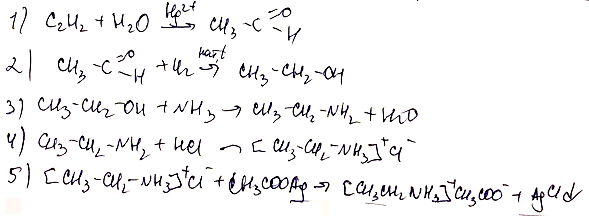
В 19 задании очень странные ответы. Спиртовой раствор щелочи отщепляет галогеноводород. Реакция ОТЩЕПЛЕНИЯ. С ОВР согласен частично.
Здравствуйте. Да, там в условии была ошибка. Правильный ответ не замещения, а отщепления. Спасибо за внимательность!