Скачать Пробный вариант 2. ЕГЭ 2021 по химии с ответами в формате pdf
Вариант 2
Часть 1
Ответом к заданиям 1–26 является последовательность цифр. Ответ запишите в поле ответа в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Последовательность цифр записывайте без пробелов, запятых и других дополнительных символов. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. Цифры в ответах на задания 5, 8, 9, 11, 16, 17, 21–26 могут повторяться.
Для выполнения заданий 1–3 используйте следующий ряд химических элементов. Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
1) С 2) O 3) Cl 4) Cu 5)Ne
- Определите, атомы каких из указанных в ряду элементов в основном состоянии содержат 2 неспаренных электрона.
Запишите в поле ответа номера выбранных элементов.
- Из указанных в ряду химических элементов выберите три элемента, которые образуют оксиды.
Расположите выбранные элементы в порядке усиления кислотных свойств их высших оксидов.
|
|
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
- Из числа указанных в ряду химических элементов выберите два элемента, которые в составе образованных ими анионов с общей формулой ЭОхy— могут проявлять высшую степень окисления.
Запишите в поле ответа номера выбранных элементов.
- Из предложенного перечня выберите два вещества, в которых между молекулами образуется водородная связь.
1) этанол
2) метилэтиловый эфир
3) фосфин
4) фтороводород
5) этаналь
Запишите в поле ответа номера выбранных веществ.
- Усоответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА |
| А) K3[Fe(CN)6] | 1) смешанные соли |
| Б) 2CaSO4∙H2O | 2) двойные соли |
| В) CaCO3∙MgCO3 | 3) комплесные соли |
| 4) кристаллогидраты |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два простых вещества-металла, которые реагируют с концентрированной азотной кислотой при комнатной температуре.
1) P4
2) C
3) Cr
4) Zn
5) Ag
Запишите в поле ответа номера выбранных веществ.
- В двух пробирках находился раствор карбоната аммония. В первую пробирку добавили раствор вещества Х, а во вторую – раствор сильного электролита Y. В первой пробирке образовался белый осадок, а во второй – выделился газ, при растворении которого в водном растворе фенолфталеина не происходит изменения окраски. Из предложенного перечня выберите вещества Х и Y, которые могут вступить в описанные реакции.
1) KCl
2) HF
3) HClO4
4) NaOH
5) BaCl2
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может реагировать: к каждой позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) Al | 1) AgNO3, RbOH, Na3PO4 |
| Б) Fe2O3 | 2) S8, Na, Hg |
| В) ZnCl2 | 3) HMnO4, Zn, HBr |
| Г) HNO3 (конц.) | 4) Sr(OH)2, O2, HI |
| 5) Zn, H2O, CO |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между исходными веществами и продуктами их взаимодействия: к каждой позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) K2Cr2O7 + FeSO4 + H2SO4 → | 1) K2SO3 + Cr2(SO4)3 + H2O |
| Б) K2Cr2O7 + Na2SO3 + H2O → | 2) KOH + Cr(OH)3 + Fe2(SO4)3 |
| В) K2Cr2O7 + Na2SO3 + H2SO4 → | 3) K2SO4 + Cr2(SO4)3 + Fe2(SO4)3 + H2O |
| Г) K2Cr2O7 + SO2 + H2SO4 → | 4) K2SO4 + Cr2(SO4)3 + H2O |
| 5) K2SO4 + Cr2(SO4)3 + Na2SO4 + H2O | |
| 6) KOH + Cr(OH)3 + Na2SO4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Задана следующая схема превращений:
 Определите, какие из указанных веществ являются веществами Х и Y.
Определите, какие из указанных веществ являются веществами Х и Y.
1) Na3PO4
2) P
3) PCl3
4) P2O5
5) NaH2PO4
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА |
А)  |
1) предельные карбоновые кислоты |
Б) 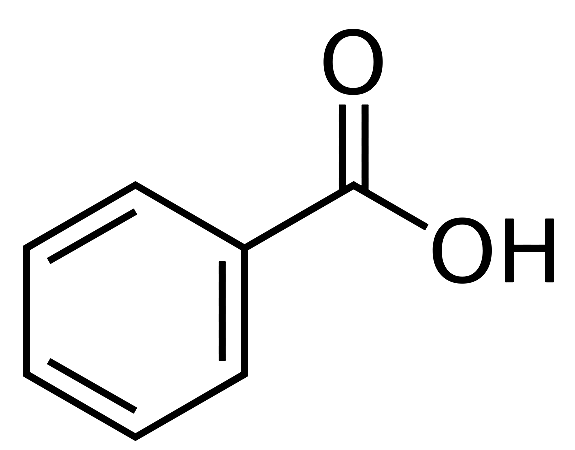 |
2) непредельные карбоновые кислоты |
| В) С2H5COOH | 3) ароматические карбоновые кислоты |
| 4) дикарбоновые кислоты |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два вещества, молекулы которых содержат атомы углерода как в состоянии sp2-, так и в состоянии sp-гибридизации.
1) дивинил
2) фенилацетилен
3) винилацетилен
4) полиизопрен
5) пропин
- Из предложенного перечня выберите два вещества, которые в соотвествующих условиях могут присоединить 3 моль брома на 1 моль исходного вещества.
1) C6H6
2) C3H8
3) C4H6
4) C2H2
5) С4H4
- Из предложенного перечня выберите два реагента, которые вступают в реакцию с циклопентанолом.
1) H2
2) NH3
3) KMnO4 (H+)
4) NaOH
5) Zn
- Из предложенного перечня выберите два наиболее вероятных продукта гидролиза этилового эфира α-аминопропионовой кислоты в присутствии бромоводородной кислоты.
1) CH3CH(NH2)COOH
2) CH2(NH2)CH2COOH
3) [CH3CH(NH3)COOH]Br
4) C2H5Br
5) C2H5OH
- Установите соответствие между формулой вещества и формулой продукта, который преимущественно образуется при его взаимодействии с бромоводородом в соотношении 1 : 1: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ФОРМУЛА ПРОДУКТА |
А) 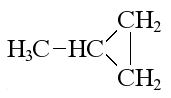 |
1) CH3-CH2-CH2-CH2-Br |
| Б) CH2=CH-CH2-CH3 | 2) 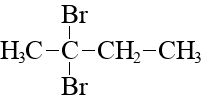 |
| В) CH3-C≡C-CH3 | 3) 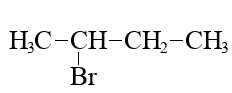 |
| Г) CH2=CH-CH=CH2 | 4) |
| 5) |
|
| 6) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между схемой химической реакции и органическим продуктом, который преимущественно в ней образуется: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ПРОДУКТ |
| А) этанол → (в присутствии H2SO4 (конц.) | 1) метилацетат |
| Б) этанол + уксусная кислота → | 2) пентанон-3 |
| В) метанол + уксусная кислота → | 3) этан |
| Г) ацетат калия + бромэтан → | 4) этин |
| 5) диэтиловый эфир | |
| 6) этилэтаноат |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Задана схема превращений веществ:
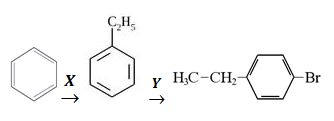 Определите, какие из указанных веществ являются веществами Х и Y.
Определите, какие из указанных веществ являются веществами Х и Y.
1) HBr
2) C2H4
3) Br2 (hv)
4) C2H6
5) Br2 (Fe3+)
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите схемы экзотермических реакций.
1) SrCO3 →
2) Cu(OH)2 →
3) Al + I2 →
4) CH4 + O2 →
5) H2 + I2 →
Запишите номера выбранных ответов.
- Из предложенного перечня выберите вещества, которые с наибольшей скоростью реагируют с концентрированной азотной кислотой при н.у.
1) Pt
2) Fe(OH)3
3) Al
4) CuO
5) Cr
Запишите номера выбранных ответов.
- Установите соответствие между уравнением реакции и названием вещества, являющимся окислителем в данной реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | ОКИСЛИТЕЛЬ |
| А) 3Hg + 8HNO3 = 3Hg(NO)2 + 2NO + 4H2O | 1) HNO3 |
| Б) 3HgO + 2NH3 = 3Hg + N2 + 3H2O | 2) O2 |
| В) 2NO + O2 = 2NO2 | 3) Hg |
| 4) NO | |
| 5) NH3 | |
| 6) HgO |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названием соли и продуктом, который образуется на инертном аноде в результате её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | ПРОДУКТ ЭЛЕКТРОЛИЗА НА АНОДЕ |
| А) сульфат калия | 1) сернистый газ |
| Б) перхлорат кальция | 2) кислород |
| В) бромид алюминия | 3) оксид хлора (V) |
| Г) хлорид ртути (II) | 4) бром |
| 5) хлор | |
| 6) водород |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между формулой соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
| А) Hg(NO3)2 | 1) гидролизуется по катиону |
| Б) Na2HPO4 | 2) гидролизуется по аниону |
| В) NH4Br | 3) гидролизу практически не подвергается |
| Г) SrCO3 | 4) гидролизуется по катиону и аниону |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между фактором, действующим на равновесную систему
C2H4 (г) + H2 (г) ↔ C2H6 (г) + Q
и направлением смещения химического равновесия в этой системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) добавление платины | 1) смещается вправо |
| Б) увеличение общего давления | 2) смещается влево |
| В) охлаждение | 3) практически не смещается |
| Г) добавление ацетилена | 4) НЕ возможно оценить без вычислений |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРИЗНАКИ РЕАКЦИИ |
| А) этановая кислота и цезий | 1) растворение осадка |
| Б) изопропиловый спирт и барий | 2) образование осадка |
| В) гидроксид цинка и муравьиная кислота | 3) выделение газа |
| Г) бромная вода и хлоропрен | 4) обесцвечивание раствора |
| 5) нет видимых признаков |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между аппаратом химического производства и процессом, протекающим в этом аппарате: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| АППАРАТ | ПРОЦЕСС |
| А) доменная печь | 1) окисление оксида серы (IV) |
| Б) контактный аппарат | 2) выплавка чугуна |
| В) компрессор | 3) сжатие воздуха для выделения азота |
| 4) поглощение серного ангидрида |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответом к заданиям 27–29 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Затем перенесите это число в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. Единицы измерения физических величин в бланке ответа указывать не нужно.
При проведении расчётов для всех элементов кроме хлора используйте значения относительных атомных масс, выраженных целыми числами (Ar(Cl) =35,5).
- Какую массу 63%-ного раствора азотной кислоты надо добавить к 122 г воды, чтобы получить 20%-й раствор? (Ответ округлите до ближайшего целого числа.)
Ответ: ___________ г.
- Избыток белого фосфора сгорает согласно термохимическому уравнению Р4(т) + 3О2(г) → Р4О6(т) + 1505 кДж. Подожгли белый фосфор массой 3,72 г. Если выход продукта реакции составляет 80%, то какое количество теплоты в кДж выделилось в результате реакции? (Запишите число с точностью до сотых.)
Ответ: ___________ кДж.
- Вычислите массу кислорода (в граммах), необходимого для неполного сжигания 6,72 л (н.у.) сероводорода. (Запишите число с точностью до десятых.)
Ответ: ___________ г.
Часть 2
Для записи ответов на задания 30–35 используйте БЛАНК ОТВЕТОВ № 2. Запишите сначала номер задания (30, 31 и т.д.), а затем его подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 30, 31 используйте следующий перечень веществ: оксид меди (II), фторид калия, сернистый газ, хлор, хлорид железа (II), гидроксид натрия. Допустимо использование водных растворов веществ.
- Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется бесцветный раствор и выпадает бурый осадок. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
- Из предложенного перечня выберите два вещества, при протекании реакции ионного обмена между которыми образуется осадок белого цвета. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
- Оксид алюминия растворили в водном растворе гидроксида натрия. К получившемуся раствору добавили избыток раствора азотной кислоты. Затем добавили избыток раствора сульфида калия2. Образовавшийся осадок выделили и прокалили. Напишите уравнения четырёх описанных реакций.
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
 При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.
При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.
- К 500 мл раствора гидроксида бария с плотностью 1,02 г/мл постепенно при перемешивании добавляли раствор гидрокарбоната натрия с массовой долей соли 5%. К тому моменту, когда соотношение числа ионов натрия и гидроксид-ионов в растворе стало равно 1:1, масса раствора стала равной 658,3 г. Определите массовые доли веществ в растворе, который получится при медленном добавлении 100 мл такого же исходного раствора гидроксида бария к раствору гидрокарбоната натрия, масса которого в два раза меньше, а массовая доля соли такая же, как и в первом эксперименте.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
- При сгораниии 9,9 г органического вещества А получили 12,096 л углекислого газа, 0,672 л азота (н.у.) и 5,94 г воды.
Известно, что вещество А подвергается и щелочному и кислотному гидролизу, при этом образуется первичный насыщенный одноатомный спирт (молекула которого содержит 2 атома углерода) и органическая соль (соль образуется при любом типе гидролиза). Также известно, что вещество А можно получить каталитическим гидрированием вещества Б, в котором заместители максимально удалены друг от друга.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции получения вещества А путём каталитического гидрирования вещества Б (используйте структурные формулы органических веществ).
Ответы:
Первая часть:
- 12
- 413
- 13
- 14
- 342
- 45
- 53
- 4312
- 3654
- 21
- 231
- 23
- 15
- 23
- 35
- 3345
- 5616
- 25
- 34
- 24
- 162
- 2245
- 1213
- 3112
- 3314
- 213
- 57
- 36,12
- 4,8
Вторая часть:
- 2FeCl2 + 6NaOH + Cl2 = 2Fe(OH)3 + 6NaCl
Fe+2 – 1e = Fe+3 2
Cl20 + 2e = 2Cl-1 1
Хлор в степени окисления 0 (или Cl2) является окислителем.
Железо в степени окисления +2 (или FeCl2) является восстановителем.
- 2KF + FeCl2 = FeF2↓ + 2KCl
2K+ + 2F— + Fe2+ + 2Cl— = FeF2↓ + 2K+ + 2Cl—
Fe2+ + 2F— = FeF2↓
- 1) Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
2) Na[Al(OH)4] + 4HNO3 = NaNO3 + Al(NO3)3 + 4H2O
3) 2Al(NO3)3 + 3K2S + 6H2O = 3H2S↑ + 2Al(OH)3↑ + 6KNO3
4) 2Al(OH)3 = Al2O3 + 3H2O (при нагревании)
Видео-объяснение смотрите на Ютуб по ссылке или ниже:
- 1) исходное органическое вещество точно содержит в своём составе атомы элементов углерод, азот и водород, так как при сгорании этого вещества образуются углекислый газ, газ азот и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода, азота и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода, азота и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, n = V/Vm
m = n ∙ M,
n (CO2) = 12,096 л / 22,4 л/моль = 0,54 моль
n (С) = n (СО2) = 0,54 моль
m (C) = 0,54 моль ∙ 12 г/моль = 6,48 г
М(Н2О) = 18 г/моль
n (H2O) = 5,94 г / 18 г/моль = 0,33 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,33 моль = 0,66 моль
m (H) = 0,66 моль ∙ 1 г/моль = 0,66 г
n (N2) = 0,672 л / 22,4 л/моль = 0,03 моль
n (N) = 2 ∙ n (N2) = 2 ∙ 0,03 моль = 0,06 моль
m (N) = 0,06 моль ∙ 14 г/моль = 0,84 г
m (C) + m (H) + m (N) = 6,48 г + 0,66 г + 0,84 г = 7,98 г, что НЕ равно массе исходного вещества, а значит атомы кислорода присутствуют в веществе.
m (O) = 9,9 г – 7,48 г = 1,92 г
n (O) = 1,92 г / 16 г/моль = 0,12 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (N) : n (O) = 0,54 : 0,66 : 0,06 : 0,12 = 9 : 11 : 1 : 2
Следовательно молекулярная формула вещества: C9H11NO2.
2) Анализируя информацию о веществе А, можно предположить, что гидролизу подвергаются такие классы органических веществ, как эфиры (включая жиры), углеводы, пептиды, ангидриды кислот и некоторые другие. Но с образованием спирта гидролизуются только эфиры. Причём если молекула спирта содержит только два атома углерода, то делаем вывод, что вещество А – это сложный эфир некой кислоты и спирта этанола. Необходимо заметить, что в независимости от тиипа гидролиза образуется соль, а такое возможно для аминокислот. Следовательно мы имеем сложный эфир, состоящий из остатков спирта этанола и некой аминокислоты, причем ароматической, так как молекулярная формула содержит малое количество атомов водорода. Используя информацию о получении вещества А гидрированием вещества Б, делаем вывод, что вещество Б –нитросоединение, содержащее NO2-группу, потому что при гидрировании нитро-группа переходит в амино-группу (NH2-). А также понимаем, что эта нитро-группа находится в пара-положении, так как только это положение подходит под описание, когда заместители максимально удалены друг от друга, там же будет и NH2-группа.
Следовательно, структурная формула — 
3) Уравнение получения вещества А путём гидрирования вещества Б:
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет (реальные, пробные и тренировочные задания) вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку


