Классификация и свойства оксидов
Как вы уже знаете, все вещества делятся на простые и сложные. В свою очередь сложные вещества делятся на четыре класса: оксиды, основания, кислоты и соли. Каждое из неорганических соединений так или иначе является представителем какого-либо одного класса веществ, хотя есть и исключения. Так, например, пероксид бария BaO2 хотя и относится к классу оксидов, проявляет свойства солей.
Оксидами же называются сложные вещества, состоящие из двух элементов, один из которых кислород, т.е. оксид – это соединение элемента с кислородом.
Название оксидов образуется от названия элемента, входящего в состав оксида. Например, BaO – оксид бария. Если образующий оксид элемент имеет переменную валентность, то после названия элемента в скобках указывается его валентность римской цифрой. Например, FeO – оксид железа (I), Fe2О3 – оксид железа (III).
Элементы, обладающие постоянной валентностью, образуют только основные, кислотные или амфотерные оксиды. Элементы с переменной валентностью могут образовывать различные оксиды.
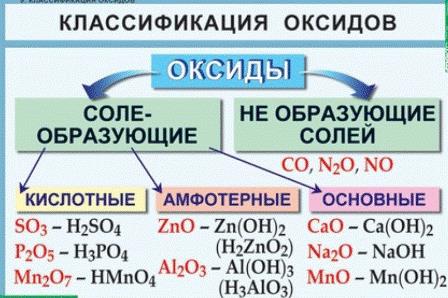
Все оксиды делятся на солеобразующие и несолеобразующие. Немногочисленные несолеобразующие оксиды не взаимодействуют ни с кислотами, ни с основаниями. К ним относятся оксид азота N2O (I), оксид азота NO (II), оксид кремния (II) и оксид углерода (II).
По своим химическим свойствам оксиды делятся на основные, кислотные и амфотерные.
Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами:
CuO + H2SO4 = CuSO4 + H2O
Растворимые в воде основные оксиды (оксиды металлов I и IIA группы из периодической системы) вступают в реакцию с водой, образуя основания:
CaO + H2O = Ca(OH) 2
Большинство основных оксидов с водой не взаимодействуют, но им также соответствуют основания, которые можно получить косвенным путем.
Основные оксиды реагируют с кислотными оксидами, образуя соли:
Na2O + SO3 = Na2SO4
Кислотными называются оксиды, которые образуют соли при взаимодействии с основаниями или основными оксидами. Кислотные оксиды также называются ангидридами кислот. Кислотными являются оксиды типичных неметаллов, а также оксиды ряда металлов в высших степенях окисления (B2O3; Mn2O7).
Многие кислотные оксиды соединяются с водой, образуя кислоты:
N2O3 + H2O = 2HNO2
SO3 + H2O = H2SO4
Не все ангидриды реагируют с водой, в этом случае соответствующие им кислоты добываются косвенным путем.
Кислотные оксиды реагируют с основными оксидами с образованием соли:
CO2 + CaO = CaCO3
Кислотные оксиды взаимодействуют с основаниями, образуя соль и воду:
CO2 + Ba(ОН)2= BaCO3 + H2O
Амфотерными называются оксиды, которые образуют соли при взаимодействии как с кислотами, так и с основаниями. Соединения этих оксидов с водой могут иметь кислотные и основные свойства одновременно, например – Al2O3, Cr2O3, MnO2; Fe2O3 ZnO. К примеру, амфотерный характер оксида цинка проявляется при взаимодействии его как с соляной кислотой, так и с гидроксидом натрия:
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2NaOH = Na2ZnO2 + H2O (при нагревании)
ZnO + 2NaOH + H2O= Na2[Zn(OH)4] (в растворе)
Так как далеко не все амфотерные оксиды растворимы в воде, то доказать амфотерность таких оксидов заметно сложнее. Например, оксид алюминия (III) в реакции сплавления его с дисульфатом калия проявляет основные свойства, а при сплавлении с гидроксидами – кислотные:
Al2O3 + 3K2S2O7 = 3K2SO4 + A12(SO4)3
Al2O3 + 2KOH = 2KAlO2 + H2O
У различных амфотерных оксидов двойственность свойств может быть выражена в различной степени. Например, оксид цинка одинаково легко растворяется и в кислотах, и в щелочах, а оксид железа (III) – Fe2O3 – обладает преимущественно основными свойствами.
Способы получения оксидов из простых веществ – это либо прямая реакция элемента с кислородом:
2Ca + O2 = 2CaO
либо разложение сложных веществ:
а) оксидов
4CrO3 = 2Cr2O3 + 3O2
б) гидроксидов
Ca(OH)2 = CaO + H2O
в) кислот
H2CO3 = H2O + CO2
г) солей
CaCO3 = CaO +CO2
А также взаимодействие кислот – окислителей с металлами и неметаллами:
Cu + 4HNO3(конц) = Cu(NO3) 2 + 2NO2 + 2H2O
Также вы можете посмотреть ВИДЕО-уроки на эту тему:
И выполнить задания из ЦТ и ЕГЭ на эту тему вы можете здесь