Характерной особенностью окислительно-восстановительных реакций является изменение степени окисления, по меньшей мере двух атомов: окисление одного (потеря электронов) и восстановление другого (присоединение электронов).
Окисление и восстановление — два полупроцесса, самостоятельное существование каждого из которых невозможно, но их одновременное протекание обеспечивает прохождение окислительно-восстановительного процесса.
Вещества, содержащие атомы, которые понижают свою степень окисления и присоединяют электроны, называются окислителями, а вещества, содержащие атомы, которые повышают степень окисления и отдают электроны — восстановителями.
Еще есть такое шутливое правило:
окислитель — грабитель,
восстановитель — потерпевший.
Если в роли окислителей и восстановителей выступают простые вещества, названия реагентов совпадают с названиями атомов, изменяющих свои степени окисления. Так, в реакции
2Na + Cl2 = 2NaCl
окислителем является простое вещество — хлор, поскольку оно содержит атомы хлора, присоединяющие электроны, а восстановителем — металлический натрий, содержащий атомы натрия, которые отдают электроны.
В реакции
K2Cr2O7 + 3K2SO3 + 4H2SO4 = Cr2 (SО4) 3 + 4K2SO4 + 4H2O
окислителем является дихромат калия, в который входят атомы хрома, присоединяющие электроны, а восстановителем — сульфит калия, в который входят атомы серы, отдающие электроны.
Существуют несколько типов окислительно-восстановительных реакций.
- Межмолекулярные окислительно-восстановительные реакции — атомы, изменяющие свои степени окисления, находятся в разных по своей химической природе атомных или молекулярных частицах. Межмолекулярные процессы составляют наибольшую часть окислительно-восстановительных реакций.
- Внутримолекулярные окислительно-восстановительные реакции — атомы, изменяющие свои степени окисления, находятся в одной и той же молекулярной частице:
2KNO3 = 2KNO2 + О2
В этом случае атомы азота, изменяющие степень окисления от +5 до +3, принимают электроны, а атомы кислорода, степень окисления которых меняется от -2 до 0, их отдают.
Среди внутримолекулярных окислительно-восстановительных реакций выделяют реакции диспропорционирования (самоокисления-самовосстановления). Они сопровождаются одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента, первоначально находящихся в одном определенном состоянии. Например, атомы хлора из степени окисления 0 переходят как в степень окисления –1 (KCl), так и в состояние +5 (KClO3):
Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
В реакциях усреднения происходит изменение степени окисления одного и того же элемента с образованием одной и той же молекулы:
2H2S + H2SO3 = 3S + 3H2O
Составление окислительно-восстановительных реакций сводится к подбору коэффициентов при окислителе и восстановителе. Главная закономерность — в окислительно-восстановительных процессах общее число электронов, присоединяемых окислителем, равно общему числу электронов, отдаваемых восстановителем. Следует пользоваться примерно таким алгоритмом подбора коэффициентов (метод электронного баланса).
- Написать схему уравнения без коэффициентов, то есть указать исходные вещества и продукты реакций.
- Найти элементы, изменяющие степень окисления, и цифрами над символами этих элементов указать степень окисления.
- Указать процессы окисления и восстановления с учетом количества атомов элементов, участвующих в этих процессах
- Определить основные коэффициенты при окислителе и восстановителе. Вводят дополнительные множители, устанавливающие электронный баланс. Их подбирают по правилу нахождения наименьшего общего кратного и получают стехиометрические коэффициенты при окислителе и восстановителе.
- Расставляют коэффициенты перед прочими реагентами.
- Проверяют число атомов водорода и кислорода в левой и правой частях уравнения и определяют число участвующих в реакции молекул воды.
Например:
+2 +5 +3 +6 +4
FeS2 + HNO3 = Fe(NO3) 3 + H2SO4 + NO2 + H2O
Записываем полуреакции окисления и восстановления:
+2 +3 -1 +6
Fe – e = Fe , 2S – 14e = 2S, и далее:
+3 +6 +5 +4
FeS2 – 15e = Fe + 2S, N + e = N
Общее кратное 15, ставим его перед NO2 в левой части уравнения, подбираем прочие коэффициенты:
FeS2 + 18HNO3 = Fe(NO3) 3 + 2H2SO4 + 15NO2 + 7H2O
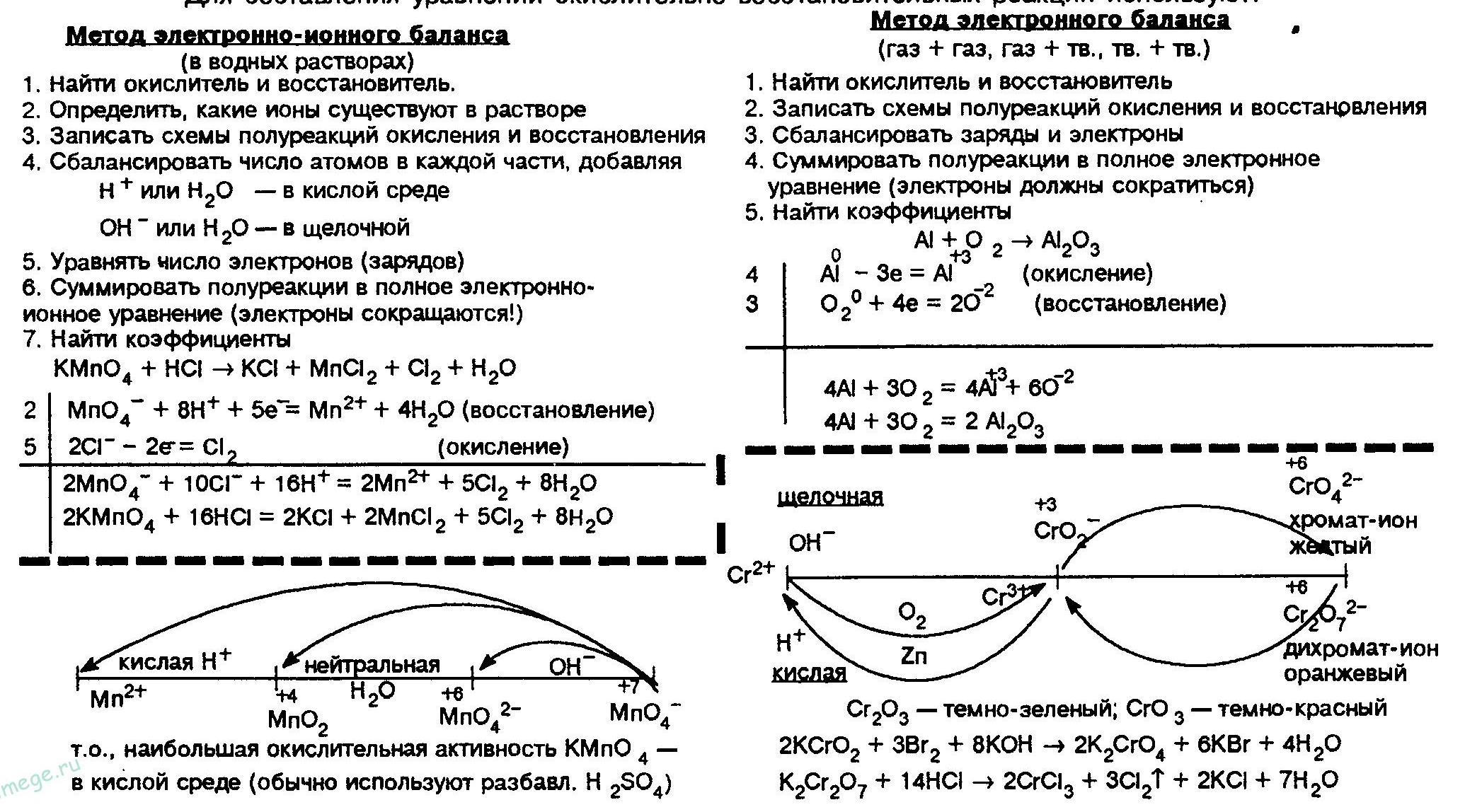 И несколько примеров расстановки коэффициентов методом электронного баланса из заданий ЕГЭ и ЦТ:
И несколько примеров расстановки коэффициентов методом электронного баланса из заданий ЕГЭ и ЦТ:
Также вы можете посмотреть ВИДЕО-уроки на эту тему:
И выполнить задания из ЦТ и ЕГЭ на эту тему вы можете здесь


