Связь атомов посредством общих электронных пар называется ковалентной связью. Как считают в настоящее время, образование общих электронных пар происходит между неспаренными электронами, причем они должны иметь разные спины. Атомы, имеющие неспаренные электроны с параллельными спинами отталкиваются, и химическая связь между ними не возникает.
Различают неполярную и полярную ковалентную связь.
При ковалентной неполярной связи электронное облако распределяется в пространстве на одинаковом расстоянии от ядер атомов. Такая связь возникает между молекулами, состоящими из одинаковых атомов ( например, молекулы водорода и кислорода)
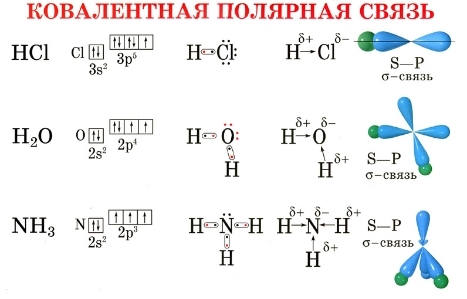
 При ковалентной полярной связи электронное облако смещено к атому с большей электроотрицательностью (разница <2.0). Электроотрицательность — это свойство атомов оттягивать к себе электроны, связывающие их с другими атомами.
При ковалентной полярной связи электронное облако смещено к атому с большей электроотрицательностью (разница <2.0). Электроотрицательность — это свойство атомов оттягивать к себе электроны, связывающие их с другими атомами.
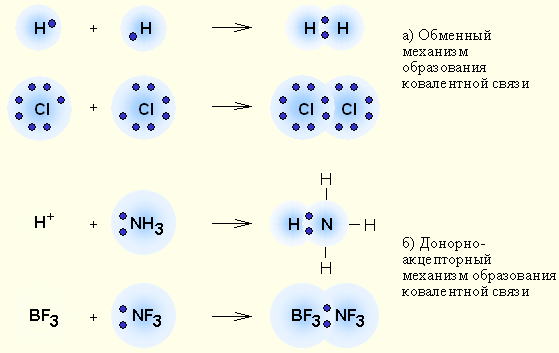
 Часто число образуемых элементом связей превосходит число неспаренных электронов в его атомах. Это объясняется существованием особого донорно-акцепторного механизма образования ковалентной связи. Он заключается в том, что ковалентная связь образуется в результате оттягивания уже существующей электронной пары донора (поставщика неподеленных электронных пар) на свободную орбиталь акцептора. Донорно-акцепторный механизм хорошо иллюстрируется схемой образования иона аммония
Часто число образуемых элементом связей превосходит число неспаренных электронов в его атомах. Это объясняется существованием особого донорно-акцепторного механизма образования ковалентной связи. Он заключается в том, что ковалентная связь образуется в результате оттягивания уже существующей электронной пары донора (поставщика неподеленных электронных пар) на свободную орбиталь акцептора. Донорно-акцепторный механизм хорошо иллюстрируется схемой образования иона аммония
 В ионе аммония каждый атом водорода связан с атомом азота общей электронной парой, одна из которых реализована по донорно-акцепторному механизму. Связи H-N, образованные по различным механизмам, никаких различий в свойствах не имеют, т. е. возникающие ковалентные связи равноценны. Это обусловлено тем, что орбитали 2s- и 2р-электронов атома азота изменяют свою форму, в результате чего возникают четыре совершенно одинаковые по форме орбитали. Форма этих новых орбиталей представляет из себя нечто среднее между s- и р-орбиталями, поэтому эти новые орбитали называются гибридными, а их возникновение — гибридизацией атомных орбиталей. Число гибридных орбиталей всегда равно числу исходных.
В ионе аммония каждый атом водорода связан с атомом азота общей электронной парой, одна из которых реализована по донорно-акцепторному механизму. Связи H-N, образованные по различным механизмам, никаких различий в свойствах не имеют, т. е. возникающие ковалентные связи равноценны. Это обусловлено тем, что орбитали 2s- и 2р-электронов атома азота изменяют свою форму, в результате чего возникают четыре совершенно одинаковые по форме орбитали. Форма этих новых орбиталей представляет из себя нечто среднее между s- и р-орбиталями, поэтому эти новые орбитали называются гибридными, а их возникновение — гибридизацией атомных орбиталей. Число гибридных орбиталей всегда равно числу исходных.
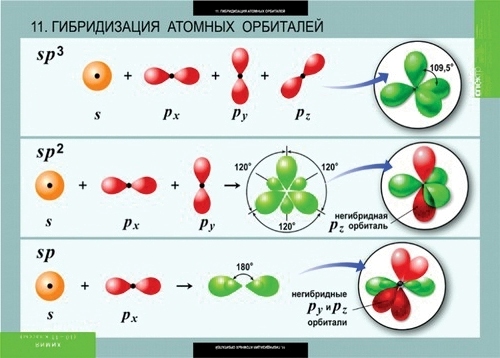
В зависимости от числа участвующих в гибридизации р-орбиталей гибридные орбитали имеют разную ориентацию в пространстве. У атома с одним s-электроном и одним р-электроном возникают две гибридные орбитали, расположенные под углом 180°. Гибридизация одной s-орбитали и двух р-орбиталей (sp2-гибридизация) образует три гибридные орбитали, расположенные в плоскости под углом 120°. Гибридизация одной s- и трех р-орбиталей (sр3-гибридизация) приводит к образованию четырех гибридных орбиталей. Их расположение в пространстве имеет форму тетраэдра, валентный угол составляет 109°23′.
 Число ковалентных связей, которое способен образовывать некоторый атом в каждом конкретном случае ограничено числом тех валентных орбиталей, использование которых для образования ковалентных связей оказывается энергетически выгодным. Это свойство атома называется насыщаемостью ковалентной связи.
Число ковалентных связей, которое способен образовывать некоторый атом в каждом конкретном случае ограничено числом тех валентных орбиталей, использование которых для образования ковалентных связей оказывается энергетически выгодным. Это свойство атома называется насыщаемостью ковалентной связи.
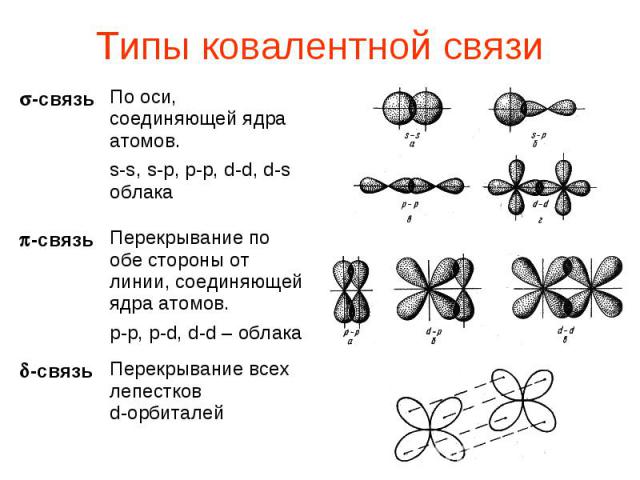
Химическая связь, образованная в результате перекрывания электронных облаков вдоль условной линии, соединяющей центры атомов, называется s-связью.
Связь, образованная при перекрывании электронных облаков, расположенных перпендикулярно условной линии, соединяющей центры атомов, называется p-связью. В молекуле может присутствовать одновременно как s, так и p-связь.
Взаимное расположение связывающих электронных облаков называется направленностью химической связи. Пространственная направленность ковалентной связи характеризуется некоторыми углами между связями, которые называются валентными углами.
Также вы можете посмотреть ВИДЕО-уроки на эту тему:
И выполнить задания из ЦТ и ЕГЭ на эту тему вы можете здесь