1) Первый признак классификации – по изменению степени окисления элементов, образующих реагенты и продукты.
а) окислительно-восстановительные
+2 +5 +3 +6 +4
FeS2 + 18HNO3 = Fe(NO3) 3 + 2H2SO4 + 15NO2 + 7H2O
б) без изменения степени окисления
CaO + 2HCl = CaCl2 + H2O
Окислительно-восстановительными называют реакции, сопровождающиеся изменением степеней окисления химических элементов, входящих в состав реагентов. К окислительно-восстановительным в неорганической химии относятся все реакции замещения и те реакции разложения и соединения, в которых участвует хотя бы одно простое вещество. К реакциям, идущим без изменения степеней окисления элементов, образующих реагенты и продукты реакции, относятся все реакции обмена.
2) Химические реакции классифицируются по характеру процесса, т.е по числу и составу реагентов и продуктов.
-реакции соединения или присоединения в органической химии.
Для того чтобы вступить в реакцию присоединения, органическая молекула должна иметь кратную связь (или цикл), эта молекула будет главной (субстрат). Молекула попроще (часто неорганическое вещество, реагент) присоединяется по месту разрыва кратной связи или раскрытия цикла.
NH3 + HCl = NH4Cl
CaO + CO2 = CaCO3
-реакции разложения.
Реакции разложения можно рассматривать как процессы, обратные соединению.
C2H5Br = C2H4 + HBr
Hg(NO3)2 = Hg + 2NO2 + O2
– реакции замещения.
Их отличительный признак — взаимодействие простого вещества со сложным. Такие реакции есть и в органической химии.
Однако понятие «замещение» в органике шире, чем в неорганической химии. Если в молекуле исходного вещества какой-либо атом или функциональная группа заменяются на другой атом или группу, это тоже реакции замещения, хотя с точки зрения неорганической химии процесс выглядит как реакция обмена.
Zn + CuSO4 = Cu + ZnSO4
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
– обмена (в том числе и нейтрализации).
CaO + 2HCl = CaCl2 + H2O
KCl + AgNO3 = AgCl¯ + KNO3
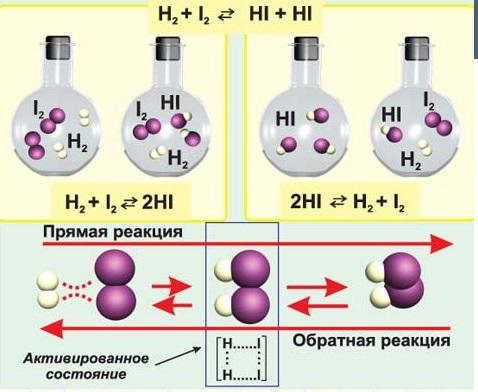
3) По возможности протекать в обратном направлении – обратимые и необратимые.
4) По типу разрыва связей – гомолитические (равный разрыв, каждый атом по 1 электрону получает) и гетеролитический (неравный разрыв – одному достается пара электронов)
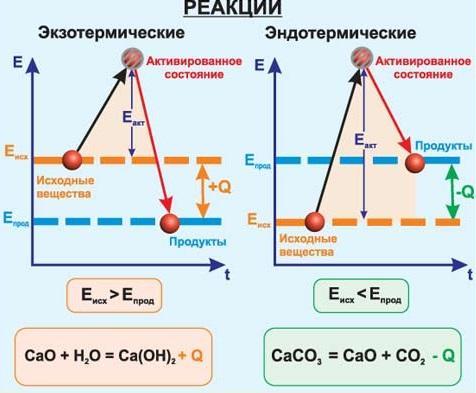
5) По тепловому эффекту
экзотермические (выделение тепла) и эндотермические (поглощение тепла). Реакции соединения как правило будут реакциями экзотермическими, а реакции разложения — эндотермическими. Редкое исключение — реакция азота с кислородом — эндотермическая:
N2 + О2 → 2NO – Q
6) По фазе
а) Гомогенные (однородные вещества, в одной фазе, например г-г, реакции в растворах)
б) Гетерогенные (г-ж, г-тв, ж-тв, реакции между несмешивающимися жидкостями)
7) По использованию катализатора. Катализатор – вещество ускоряющее химическую реакцию.
а) каталитические (в том числе и ферментативные) – без использование катализатора практически не идут.
б) некаталитические.
Классификацию химических реакций в неорганической и органической химии осуществляют на основании различных классифицирующих признаков, сведения о которых приведены в таблице ниже.
Необратимыми называют реакции, протекающие только в прямом направлении, в результате которых образуются продукты, не взаимодействующие между собой. К необратимым относят химические реакции, в результате которых образуются малодиссоциированные соединения, происходит выделение большого количества энергии, а также те, в которых конечные продукты уходят из сферы реакции в газообразном виде или в виде осадка, например:
HCl + NaOH = NaCl + H2O
2Ca + O2 = 2CaO
BaBr2 + Na2SO 4 = BaSO4↓ + 2NaBr
Обратимыми называют химические реакции, протекающие при данной температуре одновременно в двух противоположных направлениях с соизмеримыми скоростями. При записи уравнений таких реакций знак равенства заменяют противоположно направленными стрелками. Простейшим примером обратимой реакции является синтез аммиака взаимодействием азота и водорода:
N2 +3H2↔2NH3
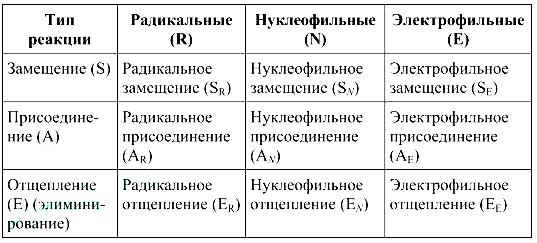
По типу разрыва химической связи в исходной молекуле различают гомолитические и гетеролитические реакции.
Гомолитическими называются реакции, при которых в результате разрыва связей образуются частицы, имеющие неспаренный электрон — свободные радикалы.
Гетеролитическими называют реакции, протекающие через образование ионных частиц — катионов и анионов.
Радикальными (цепными) называют химические реакции с участием радикалов, например:
CH4 + Cl2 hv →CH3Cl + HCl
Ионными называют химические реакции, протекающие с участием ионов, например:
KCl + AgNO3 = KNO3 + AgCl↓
Электрофильными называют гетеролитические реакции органических соединений с электрофилами — частицами, несущими целый или дробный положительный заряд. Они подразделяются на реакции электрофильного замещения и электрофильного присоединения, например:
C6H6 + Cl2 FeCl3→ C 6 H 5 Cl + HCl
H2C =CH2 + Br2 → BrCH2 –CH2Br
Нуклеофильными называют гетеролитические реакции органических соединений с нуклеофилами — частицами, несущими целый или дробный отрицательный заряд. Они подразделяются на реакции нуклеофильного замещения и нуклеофильного присоединения, например:
CH3Br + NaOH → CH3OH + NaBr
CH3C(O)H + C2H5OH → CH3CH(OC2H5)2 + H2O
Экзотермическими называют химические реакции, идущие с выделением теплоты. Условное обозначение изменения энтальпии (теплосодержания) ΔH, а теплового эффекта реакции Q. Для экзотермических реакций Q > 0, а ΔH < 0.
Эндотермическими называют химические реакции, идущие с поглощением теплоты. Для эндотермических реакций Q < 0, а ΔH > 0.
Гомогенными называют реакции, протекающие в однородной среде.
Гетерогенными называют реакции, протекающие в неоднородной среде, на поверхности соприкосновения реагирующих веществ, находящихся в разных фазах, например, твердой и газообразной, жидкой и газообразной, в двух несмешивающихся жидкостях.
Каталитические реакции протекают только в присутствии катализатора. Некаталитические реакции идут в отсутствие катализатора.
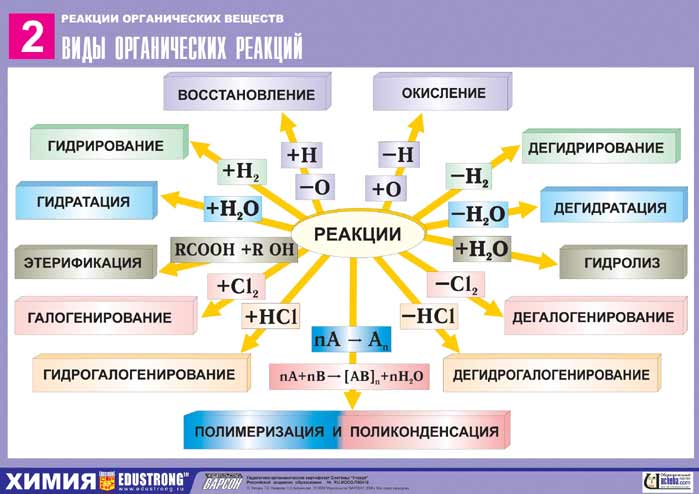
Классификация органических реакций приведена в таблице:
Также вы можете посмотреть ВИДЕО-уроки на эту тему:
И выполнить задания из ЦТ и ЕГЭ на эту тему вы можете здесь
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку