Общие сведения о кислороде
Кислород (лат. Oxygenium) впервые исследовал шведский химик К. Шееле в 1772 году. Это самый распространенный на Земле химический элемент. Массовая доля кислорода в земной коре примерно 49 %. Кислород встречается в природе в свободном (составная часть воздуха) и в связанном состоянии (вода, различные минералы, растения и животные).
Кислород в нормальных условиях – газ без цвета и запаха, аллотропная модификация – озон, газ с характерным резким запахом.
Кислород малорастворим в воде (примерно 1 объем на 20 объемов воды). При температуре –183°C кислород образует в синеватую жидкость, а при –219°C превращается в темно-синие кристаллы.
Кислород очень широко используется в технике, металлургии (при выплавке чугуна и стали, в производстве цветных металлов), для получения высоких температур при сварке металлов. Кислород применяется в медицине и в дыхательных приборах. Жидкий кислород используется как окислитель топлива в реактивных двигателях. Вместе с азотом и некоторыми другими газами кислород образует атмосферу Земли. Кислород играет важнейшую роль в жизни человека и животных.
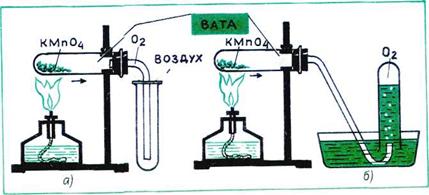
Получение кислорода
В лаборатории:
- Разложением перманганата калия при нагревании:
2KMnO4 = K2MnO4 + MnO2 + O2
Также в аналогичных реакциях разложения используют сурик Pb3O4, оксид ртути HgO, бертолетову соль КСlO3.
- Разложением пероксида водорода:
2H2O2 = 2H2O + O2
- В результате процесса фотосинтеза:
6CO2 + 6H2O = C6H12O6 + 6O2
В промышленности:
- Сжижением воздуха с помощью холодильных машин, далее, используя различие температур кипения кислорода (–183°C) и азота (–196°C), выделяют кислород.
- Чистый кислород получают электролизом воды. Это очень дорогой метод и поэтому мало распространен.
Химические свойства
В периодической системе кислород расположен в VI группе второго периода.
Атом кислорода содержит 8 электронов: 2 электрона на 1s2-орбитали и 6 на внешнем слое (электронная конфигурация 1s22s22р4). Только фтор может окислить кислород, образуя дифторид кислорода OF2. Во всех остальных соединениях степень окисления кислорода –2. Важной особенностью строения молекулы O2 – наличие двух неспаренных электронов, что приводит к эффекту парамагнетизма, т. е. свойству молекул ориентироваться в направлении магнитного поля.
Атомы кислорода образуют двухатомную молекулу с двойной связью. В обычных условиях молекулы кислорода устойчивы и на атомы не распадаются, поэтому молекулярный кислород высокой активностью не отличается.
Кислород – активный неметалл. Он образует соединения со всеми элементами, кроме гелия, неона и аргона. С галогенами, криптоном, ксеноном, золотом и металлами платиновой группы он не реагирует, и их соединения можно получить только косвенным путем. С остальными элементами кислород непосредственно взаимодействует, образуя оксиды, причем большинство реакций протекают с выделением тепла.
Так, при нагревании кислород взаимодействует с водородом, серой, углеродом, фосфором, образуя воду и оксиды:
2Н2 + О2 = 2Н2О
С + O2 = СO2
S + O2 = SO2
4Р + 5О2 = 2Р2О5
С галогенами кислород в реакцию не вступает.
Очень активно взаимодействуют с кислородом щелочные и щелочноземельные металлы с образованием оксидов (как правило, с литием), пероксидов (как правило, с натрием) и надпероксидов (как правило, с остальными щелочными металлами):
4К + О2 = 2К2О(KO2)
Ba + O2 = BaO2
С остальными металлами кислород реагирует при нагревании, выделяя большое количество теплоты и света:
2Mg + O2 = 2MgO
Некоторые металлы в обычных условиях окисляются лишь с поверхности, так как образующаяся пленка оксида защищает металл. При повышении температуры окисление ускоряется. Например, в нормальных условиях железо окисляется довольно медленно, а при температуре красного каления (≈ 400°C) железные стружки сгорают в кислороде:
3Fe + 2O2 = Fe3O4
В кислороде горят также сложные вещества с образованием соответствующих оксидов:
CH4 + 2O2 = CO2 + 2H2O