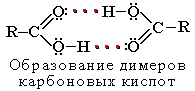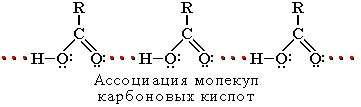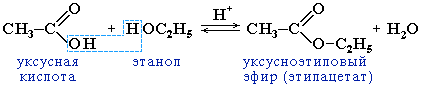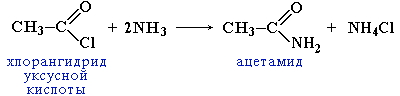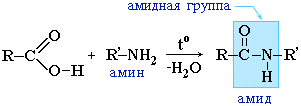Физические свойства предельных одноосновных кислот
Низшие члены этого ряда при обычных условиях представляют собой жидкости, обладающие характерным острым запахом. Например, этановая (уксусная) кислота имеет характерный «уксусный» запах. Безводная уксусная кислота при комнатной температуре представляет собой жидкость; при 17 °С она замерзает, превращаясь в льдистое вещество, которое получило название «ледяная» уксусная кислота. Средние представители этого гомологического ряда — вязкие, «маслообразные» жидкости; начиная с С10 — твердые вещества.
Простейший представитель – муравьиная кислота НСООН – бесцветная жидкость с т. кип. 101 °С, а чистая безводная уксусная кислота CH3COOH при охлаждении до 16,8 °С превращается в прозрачные кристаллы, напоминающие лед (отсюда ее название ледяная кислота).
Простейшая ароматическая кислота — бензойная C6H5COOH (т. пл. 122,4°С) — легко возгоняется, т.е. переходит в газообразное состояние, минуя жидкое. При охлаждении её пары сублимирутся в кристаллы. Это свойство используется для очистки вещества от примесей.
Карбоксильная группа сочетает в себе две функциональные группы – карбонил >C=O и гидроксил —OH, взаимно влияющие друг на друга:
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О–Н.
В водном растворе карбоновые кислоты диссоциируют на ионы:
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Химические свойства карбоновых кислот
Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.
I. Общие с другими кислотами
1. Диссоциация:
R—COOH ↔ RCOO— + H+
-Сила кислот уменьшается в ряду:
H-COOH > CH3-COOH > CH3-CH2-COOH
2. Взаимодействие с активными металлами:
2R-COOH + 2Na → 2R-COONa + H2↑
3. Взаимодействие с основными оксидами и основаниями:
2R-COOH + CaO → (R-COO)2Ca + H2O
R-COOH + NaOH → R-COONa + H2O
4. Взаимодействие с солями слабых кислот:
R-COOH + NaHCO3 → R-COONa + H2O + CO2↑
-Соли карбоновых кислот разлагаются сильными минеральными кислотами:
R-COONa + HСl → NaCl + R-COOH
-В водных растворах гидролизуются:
R—COONa + H2O ↔ R—COOH + NaOH
5. Образование сложных эфиров со спиртами:
II. Специфические свойства
1. Образование функциональных производных R—CO—X
(свойства гидроксильной группы)
Получение хлорангидридов:
R-COOH + PCl5 → R-CO-Cl + POCl3 + HCl
2. Образование амидов
CH3COOH + NH3→CH3COONH4 t˚C→ CH3CONH2 + H2O
Вместо карбоновых кислот чаще используют их галогенангидриды:
Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами):
Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из a-аминокислот с участием амидных групп — пептидных связей
3. Реакции замещения с галогенами
(свойства углеводородного радикала, образуется а-хлорпроизводное карбоновой кислоты ):
4. Особенности муравьиной кислоты H—COOH:
· Даёт реакцию «Серебряного зеркала»:
H-COOH + 2[Ag(NH3)2]OH → 2Ag↓ + (NH4)2CO3 + 2NH3 + H2O
· Окисление хлором:
H-COOH + Cl2 → CO2 + 2HCl
· Вступает в реакцию с гидроксидом меди(II):
H-COOH + 2Cu(OH)2 t → Cu2O↓ + CO2↑ + 3H2O
· Разлагается при нагревании:
HCOOH t,H2SO4→ CO↑ + H2O
5. Реакции декарбоксилирования солей карбоновых кислот
(получение алканов):
R-COONa + NaOH t → Na2CO3 + R-H (алкан)
6. Окисление в атмосфере кислорода:
R—COOH + O2 → CO2 + H2O