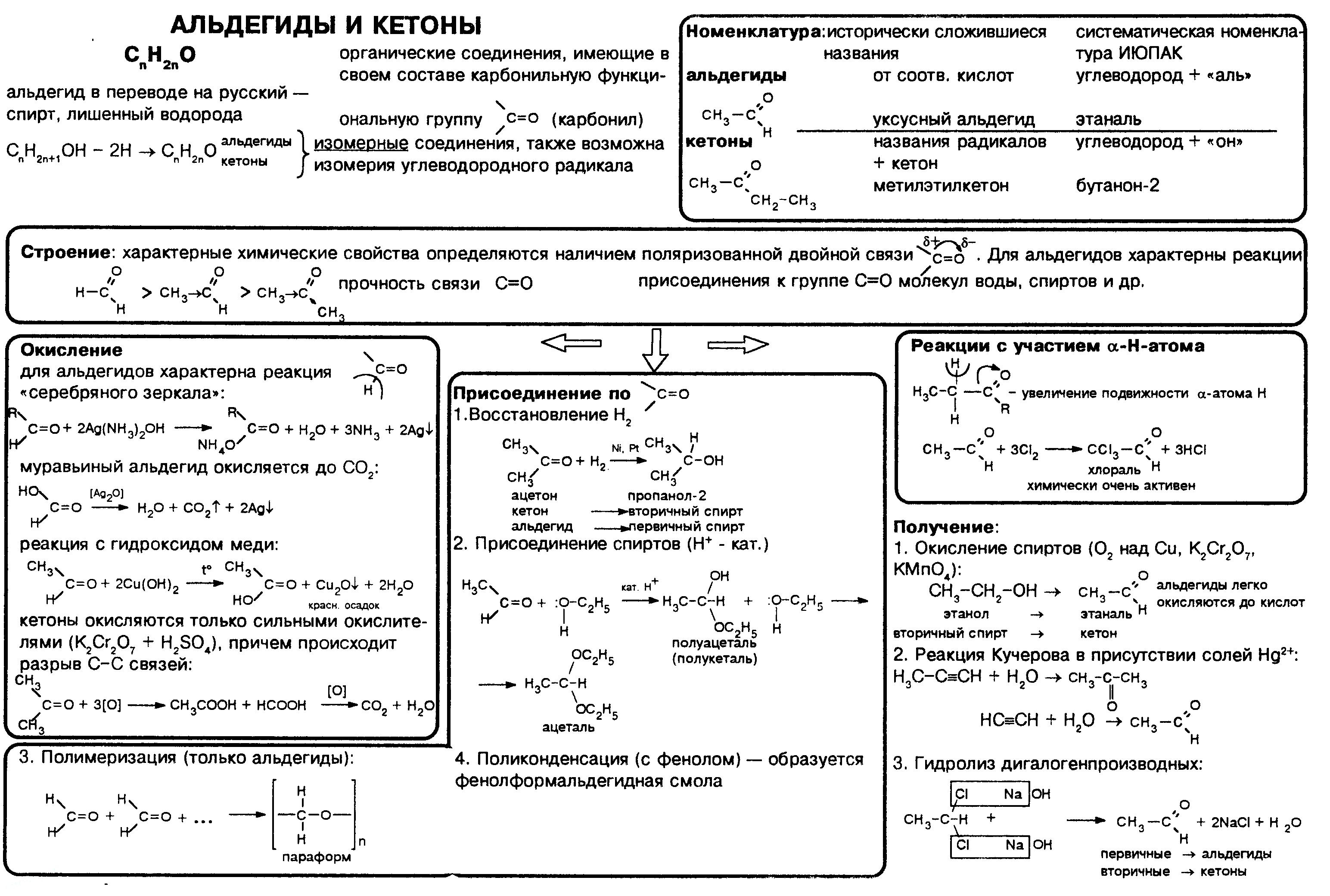
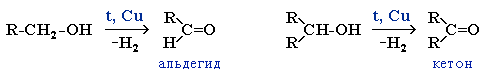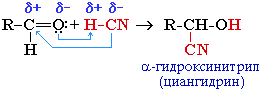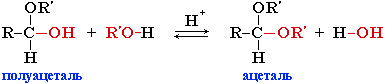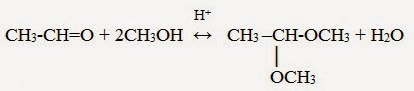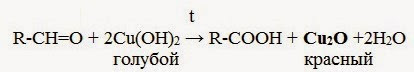Физические свойства
В молекулах альдегидов и кетонов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. Метаналь (формальдегид) — газ, альдегиды С2–C5 и кетоны С3–С4 — жидкости, высшие — твердые вещества.
Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
Химические свойства
Для карбонильных соединений характерны реакции различных типов:
· присоединение по карбонильной группе;
· полимеризация;
· конденсация;
· восстановление и окисление.
Большинство реакций альдегидов и кетонов протекает по механизму нуклеофильного присоединения (AN) по связи С=О.
Реакционная способность в таких реакциях уменьшается от альдегидов к кетонам:
Это объясняется, главным образом, двумя факторами:
· углеводородные радикалы у группы С=О увеличивают пространственные препятствия присоединению к карбонильному атому углерода новых атомов или атомных групп;
· углеводородные радикалы за счет +I-эффекта уменьшают положительный заряд на карбонильном атоме углерода, что затрудняет присоединение нуклеофильного реагента.
I. Реакции присоединения
1. Присоединение водорода (восстановление):
R-CH=O + H2 t,Ni → R-CH2-OH (первичный спирт)
2. Присоединение циановодородной кислоты (синильной):
Эта реакция используется для удлинения углеродной цепи, а также для получения α-гидроксикислот R-CH(COOH)OH по схеме:
R-CH(CN)OH + H2O -> R-CH(COOH)OH + NH3
CH3-CH=O + H-CN → CH3-CH(CN)-OH
CH3—CH(CN)-OH циангидрин –яд! в ядрах косточек вишен, слив
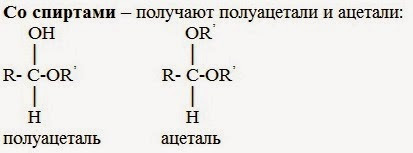
3. Со спиртами – получают полуацетали и ацетали:
Полуацетали — соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами.
Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
Ацетали — соединения, в которых атом углерода связан с двумя алкоксильными
(-OR) группами.
4. Присоединение воды:
5. Присоединение реактива Гриньяра (используется для получения первичных спиртов, кроме метанола):
R-X(р—р в диэтиловом эфире) + Mg стружка → R-Mg-X (реактив Гриньяра) + Q
Здесь R – алкильный или арильный радикал; Х – это галоген.
HCH=O + CH3—Mg—Cl → CH3—CH2—O—Mg—Cl (присоединение)
CH3—CH2—O—Mg—Cl + H2O → CH3—CH2—OH + Mg(OH)Cl (гидролиз)
6. Взаимодействие с аммиаком
II. Реакции окисления
1. Реакция серебряного зеркала – качественная реакция на альдегидную группу:
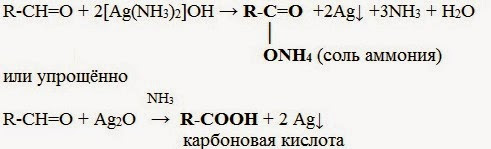 Кетоны не вступают в реакцию «серебряного зеркала». Они окисляются с трудом лишь при действии более сильных окислителей и повышенной температуре. При этом происходит разрыв С–С-связей (соседних с карбонилом) и образование смеси карбоновых кислот меньшей молекулярной массы.
Кетоны не вступают в реакцию «серебряного зеркала». Они окисляются с трудом лишь при действии более сильных окислителей и повышенной температуре. При этом происходит разрыв С–С-связей (соседних с карбонилом) и образование смеси карбоновых кислот меньшей молекулярной массы.
2. Окисление гидроксидом меди(II):
III. Реакции замещения
С галогенами:
CH3-CH=O + Cl2 → ClCH2-CH=O + HCl
здесь , ClCH2-CH=O — хлоруксусный альдегид
IV. Реакции полимеризации
n CH2=O t,kat → ( -CH2-O-)n полиформальдегид
V. Реакции поликонденсации
n H—CH=O + (n+1) C6H5—OH t,kat→ nH2O + [-C6H3(OH)-CH2—C6H3(OH)-]n фенолформальдегидная смола