Вещества, растворы или расплавы которых способны проводить электрический ток, называются электролитами. Соответственно, вещества, растворы или расплавы которых не проводят электрического тока, называются неэлектролитами. Электролитами являются кислоты, основания и большинство солей, неэлектролитами — почти все органические соединения.
В растворе или расплаве электролиты распадаются на ионы — диссоциируют. Распад электролитов на ионы при растворении их в воде называется электролитической диссоциацией.
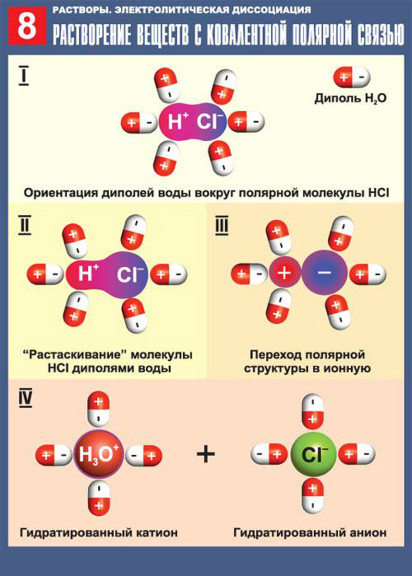
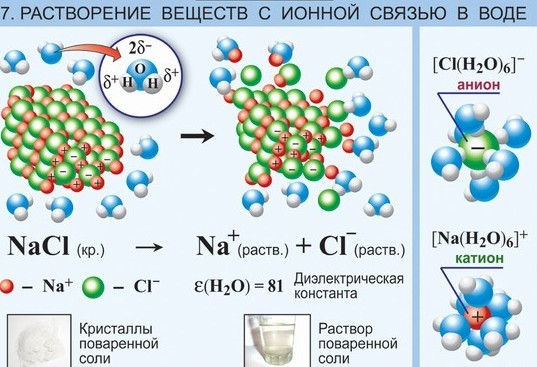
Электролитическая диссоциация происходит вследствие взаимодействия полярных молекул растворителя с молекулами или кристаллической решеткой растворяемого вещества. Молекулы растворителя разрушают кристаллическую решетку и переводят ионы в раствор в форме сольватированных заряженных частиц. Растворенное вещество и растворитель оказывают обоюдное влияние: полярные молекулы растворителя разрушают кристаллическую решетку, а высвобождающиеся ионы, переходя в раствор, вызывают упорядочивание молекул растворителя. В то же время полярные молекулы растворителя ориентированы в соответствии с зарядом ионов.
В расплавах диссоциация происходит вследствие нагревания вещества.
Идеи С. Аррениуса, разработанные в 1887 г. составили основу теории электролитической диссоциации. Согласно ей, при растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные частицы. Под действием постоянного электрического тока неупорядоченное движение ионов в растворе или расплаве прекращается: положительно заряженные ионы (они называются катионами) движутся к катоду, отрицательно заряженные (называются анионами) — к аноду. Соответственно, на катоде минус, а на аноде – плюс. Одновременно с распадом электролита на ионы происходит объединение ионов в молекулы. Поэтому электролитическая диссоциация является обратимым процессом и при написании уравнений диссоциации указывается, что реакция идет в обе стороны
Растворение любого вещества в воде сопровождается образованием гидратов. Если при этом в растворе не происходит формульных изменений у частиц растворенного вещества, то такие вещества относят к неэлектролитам. Ими являются, например, газ азот N2, жидкость хлороформ CHCl3, твердое вещество сахароза C12H22O11, которые в водном растворе существуют в виде гидратов этих молекул.
известно много веществ (в общем виде МА), которые после растворения в воде и образования гидратов молекул МА nH2O претерпевают существенные формульные изменения. В результате в растворе появляются гидратированные ионы – катионы М+ * nH2O и анионы А * nH2O:
МА * nH2O → М+ * nH2O + А– * nH2O
Такие вещества относятся к электролитам.
Процесс появления гидратированных ионов в водном растворе называется электролитической диссоциацией (С. Аррениус 1887).
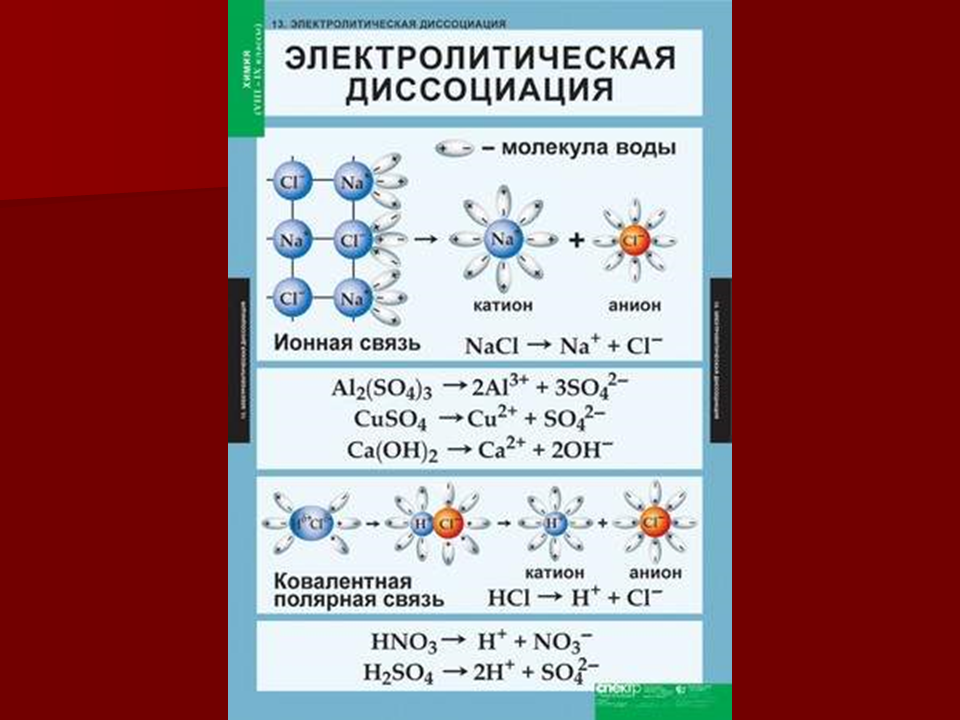
Электролитическая диссоциация ионных кристаллических веществ (М+)(А–) в воде является необратимой реакцией:
(М+)(А–)(т) →(М+)(А–)(р) =(М+)(р) + (А–)(р)
Такие вещества относятся к сильным электролитам, ими являются многие основания и соли, например:
NaOH = Na+ + OH– K2SO4 = 2K+ + SO4–
Ba(OH)2 = Ba2+ + 2OH– Na2 = 2Na+ + S2-
Электролитическая диссоциация вещества МА, состоящих из полярных ковалентных молекул, является обратимой реакцией:
(М-А)(г,ж,т) → (М-А)(р) ↔ М+(р) А–(р)
такие вещества относят к слабым электролитам, ими являются многие кислоты и некоторые основания, например:
а) HNO2 ↔ H+ + NO2-
б) CH3COOH ↔ H+ + CH3COO–
в) H2CO3 ↔ H+ + HCO3– (первая ступень)
HCO3– ↔ H+ + CO32- (вторая ступень)
г) NH3 * H2O ↔ NH4 + OH–
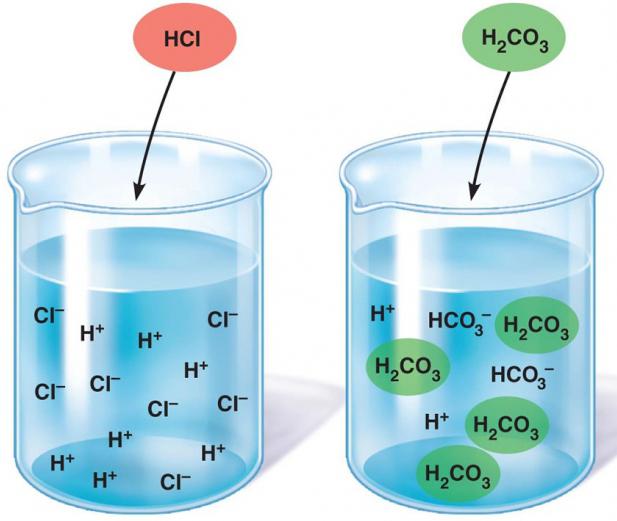
В разбавленных водных растворах слабых электролитов мы всегда обнаружим как исходные молекулы, так и продукты их диссоциации – гидратированные ионы.
Качественная характеристика диссоциации электролитов называется степенью диссоциации и обозначается ɑ1, всегда ɑ › 0.
Для сильных электролитов ɑ = 1 по определению (диссоциация таких электролитов полная).
Для слабых электролитов степень диссоциации – отношение малярной концентрации продиссоциировавшего вещества (сд) к общей концентрации вещества в растворе (с):
Степень диссоциации – это доля единицы от 100%. Для слабых электролитов ɑ ˂ С 1 (100%). Для слабых кислот HnA степень диссоциации по каждой следующей ступени резко уменьшается по сравнению с предыдущей:
H3PO4 ↔ H+ + H2PO4– = 23,5%
H2PO4– ↔ H+ + HPO42- = 3*10-4 %
HPO42-↔ H+ + PO43- = 2*10-9 %
Степень диссоциации зависит от природы и концентрации электролита, а также от температуры раствора; она растет при уменьшении концентрации вещества в растворе (т.е. при разбавлении раствора) при нагревании.
В разбавленных растворах сильных кислот HnA их гидротионы Hn-1A не существуют, например:
H2SO4 = H+ + [HSO4–]
[HSO4–] = H+ + SO4-2
В итоге: H2SO4(разб.) = 2H+ + SO4-2
в концентрированных растворах содержание гидроанионов (и даже исходных молекул) становятся заметными:
H2SO4– (конц.) ↔ H+ + HSO4– ( 1 ˂ 1)
HSO4– ↔ H+ + SO42- ( 2 ˂ 1 ˂ 1)
(суммировать уравнения стадий обратимой диссоциации нельзя!). При нагревании значения 1 и 2 возрастают, что способствует протеканию реакций с участием концентрированных кислот.
Кислоты – это электролиты, которые при диссоциации поставляют в водный раствор катионы водорода и никаких других положительных анионов не образуют:
* буквой обозначают степень протекания любых обратимых реакций, в том числе и степень гидролиза.
H2SO4 = 2H+ = SO42- , HF ↔ H+ + F–
Распространенные сильные кислоты:
Кислородсодержащие кислоты
Бескислородные кислоты
HCl, HBr, HI, HNCS
В разбавленном водном растворе (условно до 10%-ного или 0,1-молярного) эти кислоты диссоциируют полностью. Для сильных кислот HnA в список вошли их гидротионы (анионы кислых солей), также диссоциирующие полностью в этих условиях.
Распространенные слабые кислоты:
Кислородсодержащие кислоты
Бескислородные кислоты
Основание – это электролиты, которые при диссоциации поставляют в водный раствор гидроксид-ионы и никаких других отрицательных ионов не образуют:
KOH = K+ + OH–, Ca(OH)2 = Ca2+ + 2OH–
Диссоциация малорастворимых оснований Mg(OH)2, Cu(OH)2, Mn(OH)2, Fe(OH)2 и других практического значения не имеет.
К сильным основаниям (щелочам) относятся NaOH, KOH, Ba(OH)2 некоторые другие. Самым известным слабым основанием является гидрат аммиака NH3 H2O.
Средние соли – это электролиты, которые при диссоциации поставляют в водный раствор любые катионы, кроме H+, и любые анионы, кроме OH:
Cu(NO3)2 = Cu2+ + 2NO3–
Al2(SO4)3 =2Al3+ + 3SO42-
Na(CH3COO) = Na+ + CH3COO–
BaCl2 = Ba2+ + 2Cl
K2S = 2K+ + S2-
Mg(CN)2 = Mg2+ + 2CN–
речь идет не только о хорошо растворимых солях. Диссоциация малорастворимых и практически нерастворимых солей значения не имеет.
Аналогично диссоциируют двойные соли:
KAl(SO4)2 = K+ + Al3+ + 2SO42-
Fe(NH4)2(SO4)2 = Fe2+ + 2NH4 + 2SO42-
Кислые соли (большинство из них растворимы в воде) диссоциируют полностью по типу средних солей:
KHSO4 = K+ + HSO4–
KHCr2O7 = K+ + HCr2O7–
KH2PO4 = K+ + H2PO4–
NaHCO3 = Na+ + HCO3–
Образующиеся гидроанионы подвергаются, в свою очередь, воздействию воды:
а) если гидроанион принадлежит сильной кислоте, то он и сам диссоциирует также полностью:
HSO4– = H+ + HSO42-, HCr2O7–= H+ + Cr2O72-
и полное уравнение реакции диссоциации запишется в виде:
KHSO4 = K+ + H+ + SO42-
KHCr2O7 = K+ + H+ Cr2O72-
(растворы этих солей обязательно будут кислыми, как и растворы соответствующих кислот);
б) если гидротион принадлежит слабой кислоте, то его поведение в воде двойственно – либо неполная диссоциация по типу слабой кислоты:
H2PO4– ↔ H+ + HPO42- ( 1)
HCO3– ↔ H+ CO32- ( 1)
Либо взаимодействие с водой (называемым обратимым гидролизом):
H2PO4– + H2O ↔ H3PO4 + OH– ( 2)
HCO3– + H2O ↔ H2CO3 + OH– ( 2)
При 1 2 преобладает диссоциация (и раствор будет кислым), а при 1 2 – гидролиз (и раствор соли будет щелочным). Так, кислыми будут растворы солей с анионами HSO3–, H2PO4–, H2AsO4– и HSeO3, растворы солей с другими анионами (их большинство) будут щелочными. Другими словами, название «кислые» для солей с большинством гидроанионов не предполагает, что эти анионы будут вести себя в растворе как кислоты (гидролиз гидроанионов и расчет отношения между 1 и 2 изучаются только в высшей школе)
Основные соли MgCl(OH), CuCO3(OH)2 и другие в своем большинстве практически нерастворимы в воде, и обсуждать их поведение в водном растворе невозможно.
Примеры решения задач на электролитическую диссоциацию
Также вы можете посмотреть ВИДЕО-уроки на эту тему:
И выполнить задания из ЦТ и ЕГЭ на эту тему вы можете здесь