Представляем вашему вниманию задания (30-35) из резервных дней основного периода (20 июня 2019 года и 1 июля 2019 года) с подробными видео-объяснениями,текстовыми решениями и ответами.
Задание 30
Из предложенного перечня веществ выберите вещества, между которыми может протекать окислительно-восстановительная реакция. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций. Составьте электронный баланс, укажите окислитель и восстановитель в этой реакции. Дан следующий перечень веществ (смотри ниже).
Задание 31
Из предложенного перечня веществ выберите вещества, между которыми может протекать реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций. Дан следующий перечень веществ (смотри ниже).
Реальный ЕГЭ 2019 (резервные дни). Задание 30 и 31. Вариант 1.
Бромид калия, перманганат калия, нитрат стронция, карбонат аммония, оксид железа(III).
Развернуть/свернуть решение6KBr + 2KMnO4 + 4H2O = 3Br2 + 2MnO2 + 8KOH
2Br— — 2e = Br20 3 восстановитель
Mn+7 + 3e = Mn+4 2 окислитель
Sr(NO3)2 + (NH4)2CO3 = SrCO3↓ + 2NH4NO3
Sr2+ + 2NO3— + 2NH4+ + CO32- = SrCO3↓ + 2NH4+ + 2NO3—
Sr2+ + CO32- = SrCO3↓
Реальный ЕГЭ 2019 (резервные дни). Задание 30 и 31. Вариант 2.
Хромат калия, сульфид калия, сульфат меди(II), фторид аммония, серная кислота.
Развернуть/свернуть решение2K2CrO4 + 3K2S + 8H2SO4 = 3S + Cr2(SO4)3 + 5K2SO4 + 8H2O
2Cr+6 + 6e = 2Cr+3 1 окислитель
S-2 – 2e = S0 3 восстановитель
K2S + CuSO4 = CuS↓ + K2SO4
2K+ + S2- + Cu2+ + SO42- = CuS↓ + 2K+ + SO42-
Cu2+ + S2- = CuS↓
Реальный ЕГЭ 2019 (резервные дни). Задание 30 и 31. Вариант 3.
Нитрат кальция, карбонат аммония, фтороводород, перманганат калия, хлороводород.
Развернуть/свернуть решение16HCl + 2KMnO4 = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
2Cl-1 – 2e = Cl20 5 восстановитель
Mn+7 + 5e = Mn+2 2 окислитель
Ca(NO3)2 + (NH4)2CO3 = CaCO3↓ + 2NH4NO3
Ca2+ + 2NO3— + 2NH4+ + CO32- = CaCO3↓ + 2NH4+ + 2NO3—
Ca2+ + CO32- = CaCO3↓
Второй вариант (так как допускается использование водных растворов, то раствор хлороводорода – это соляная кислота)
(NH4)2CO3 + 2HCl = 2NH4Cl + H2O + CO2↑
2NH4+ + CO32- + 2H+ + 2Cl— = 2NH4+ + 2Cl— + H2O + CO2↑
2H+ + CO32- = H2O + CO2↑
Реальный ЕГЭ 2019 (резервные дни). Задание 30 и 31. Вариант 4.
Сульфит калия, хлор, гидроксид калия, ацетат аммония, нитрат алюминия.
Развернуть/свернуть решениеK2SO3 + Cl2 + 2KOH = K2SO4 + 2KCl + H2O
S+4 – 2e = S+6 1 восстановитель
Cl20 + 2e = 2Cl-1 1 окислитель
KOH + CH3COONH4 = CH3COOK + NH3↑ + H2O
K+ + OH— + CH3COO— + NH4+ = CH3COO— + K+ + NH3↑ + H2O
NH4+ + OH— = NH3↑ + H2O
Второй вариант
3KOH + Al(NO3)3 = Al(OH)3↓ + 3KNO3
3K+ + 3OH— + Al3+ + 3NO3— = Al(OH)3↓ + 3K+ + 3NO3—
Al3+ + 3OH— = Al(OH)3↓
Во втором варианте возможны также варианты образования комплексных соединений алюминия.
Реальный ЕГЭ 2019 (резервные дни). Задание 30 и 31. Вариант 5.
Дихромат натрия, серная кислота, гидрокарбонат калия, нитрит натрия, оксид кремния.
Развернуть/свернуть решениеNa2Cr2O7 + 3NaNO2 + 4H2SO4 = Cr2(SO4)3 + 3NaNO3 + Na2SO4 + 4H2O
2Cr+6 + 6e = 2Cr+3 2 окислитель
N+3 – 2e = N+5 3 восстановитель
H2SO4 + 2KHCO3 = K2SO4 + 2H2O + 2CO2↑
2H+ + SO42- + 2K+ + 2HCO3— = 2K+ + SO42- + 2H2O + 2CO2↑
H+ + HCO32- = H2O + CO2↑
Реальный ЕГЭ 2019 (резервные дни). Задание 30 и 31. Вариант 6.
Ацетат меди(II), сульфид натрия, дихромат натрия, серная кислота, нитрат аммония.
Развернуть/свернуть решениеNa2Cr2O7 + 3Na2S + 7H2SO4 = Cr2(SO4)3 + 3S + 4Na2SO4 + 7H2O
2Cr+6 + 6e = 2Cr+3 1 окислитель
S-2 – 2e = S0 3 восстановитель
(CH3COO)2Cu + H2SO4 = CuSO4 + 2CH3COOH
2CH3COO— + Cu2+ + 2H+ + SO42- = Cu2+ + SO42- + 2CH3COOH
CH3COO— + H+ = CH3COOH
Второй вариант
Na2S + H2SO4 = Na2SO4 + H2S↑
2Na+ + S2- + 2H+ + SO42- = 2Na+ + SO42- + H2S↑
2H+ + S2- = H2S↑
Реальный ЕГЭ 2019 (резервные дни). Задание 30 и 31. Вариант 7.
Дихромат натрия, гидроксид железа(III), серная кислота, оксид кремния, сульфит натрия.
Развернуть/свернуть решениеNa2Cr2O7 + 3Na2SO3 + 4H2SO4 = Cr2(SO4)3 + 4Na2SO4 + 4H2O
2Cr+6 + 6e = 2Cr+3 2 окислитель
S+4 – 2e = S+6 3 восстановитель
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
2Fe(OH)3 + 6H+ + 3SO42- = 2Fe3+ + 3SO42- + 6H2O
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
Второй вариант
Na2SO3 + H2SO4 = Na2SO4 + SO2↑ + H2O
2Na+ + SO32- + 2H+ + SO42- = 2Na+ + SO42- + SO2↑ + H2O
2H+ + SO32- = SO2↑ + H2O
Реальный ЕГЭ 2019 (резервные дни). Задание 30 и 31. Вариант 8.
Хромат калия, бромид калия, серная кислота, карбонат магния, хлорид серебра.
Развернуть/свернуть решение2K2CrO4 + 6KBr + 8H2SO4 = Cr2(SO4)3 + 3Br2 + 5K2SO4 + 8H2O
2Cr+6 + 6e = 2Cr+3 1 окислитель
2Br-1 – 2e = Br20 3 восстановитель
MgCO3 + H2SO4 = MgSO4 + H2O + CO2↑
MgCO3 + 2H+ + SO42- = Mg2+ + SO42- + H2O + CO2↑
MgCO3 + 2H+ = Mg2+ + H2O + CO2↑
Задание 32
Реальный ЕГЭ 2019 (резервные дни). Задание 32. Вариант 1.
При добавлении концентрированной хлороводородной кислоты к раствору дихромата калия выделился газ. Образовавшийся зелёный раствор добавили к раствору карбоната натрия. Выделившийся при этом газ пропустили через раствор силиката калия. Полученный осадок отделили и нагрели. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение- K2Cr2O7 + 14HCl(конц.) → 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
- 3Na2CO3 + 2CrCl3 + 3H2O → 2Cr(OH)3↓ + 6NaCl + 3CO2↑
- K2SiO3+ 2H2O + 2CO2 → H2SiO3↓ + 2KHCO3
- H2SiO3 → H2O + SiO2 (прокаливание)
Реальный ЕГЭ 2019 (резервные дни). Задание 32. Вариант 2.
Смешали растворы хлорида бария и сульфата меди(II). Выделившийся при этом осадок отделили и провели электролиз оставшегося раствора. Выделившийся на аноде газ пропустили через раствор бромида натрия. Полученное простое вещество прореагировало с горячим раствором гидроксида калия, в результате чего в растворе образовались две соли. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение- CuSO4 + BaCl2 → BaSO4↓ + CuCl2
- CuCl2 → Cu + Cl2↑ (электролиз раствора)
- Cl2 + 2NaBr → 2NaCl + Br2↓ (в растворе)
- 6KOH + 3Br2 → KBrO3 + 5KBr + 3H2O (горячий раствор)
Реальный ЕГЭ 2019 (резервные дни). Задание 32. Вариант 3.
Гидрокарбонат натрия обработали раствором гидроксида натрия. Полученный раствор смешали с раствором бромида железа(III), в результате чего выпал бурый осадок и образовался газ. Осадок отделили и прокалили. Твёрдый остаток растворили в иодоводородной кислоте. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение- NaHCO3 + NaOH → Na2CO3 + H2O
- 2FeBr3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 3CO2↑ + 6NaBr
- 2Fe(OH)3 → Fe2O3 + 3H2O (прокаливание)
- Fe2O3 + 6HI → 2FeI2 + I2 + 3H2O
Реальный ЕГЭ 2019 (резервные дни). Задание 32. Вариант 4.
Оксид цинка сплавили с твёрдым карбонатом калия. Полученное в результате твёрдое вещество растворили в необходимом количестве раствора серной кислоты. В образовавшийся раствор добавили сульфид натрия, в результате чего образовался белый осадок. Осадок отделили, высушили, а затем сожгли в избытке кислорода. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение- ZnO + K2CO3 → K2ZnO2 + CO2 (сплавление)
- K2ZnO2 + 2H2SO4 → K2SO4 + ZnSO4 + 2H2O
- ZnSO4 + K2S → ZnS↓ + K2SO4
- 2ZnS + 3O2 → 2ZnO + 2SO2
Реальный ЕГЭ 2019 (резервные дни). Задание 32. Вариант 5.
Карбид алюминия сожгли в кислороде. Полученное твёрдое вещество поместили в раствор гидроксида калия. Через образовавшийся прозрачный раствор пропустили избыток газа, полученный при действии на медь горячей концентрированной серной кислоты. При пропускании газа наблюдалось выпадение белого осадка. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение- Al4C3 + 6O2 → 2Al2O3 + 3CO2
- Al2O3 + 2KOH + 3H2O → 2K[Al(OH)4]
- Cu + 2H2SO4 → CuSO4 + SO2↑ + 2H2O
- K[Al(OH)4] + SO2 → KHSO3 + Al(OH)3↓
Реальный ЕГЭ 2019 (резервные дни). Задание 32. Вариант 6.
Кремниевую кислоту прокалили. Полученное твёрдое вещество смешали с углём и ортофосфатом кальция и прокалили. Образовавшееся простое вещество прореагировало с избытком хлора. Полученное вещество поместили в избыток раствора гидроксида бария. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение- H2SiO3 → H2O + SiO2 (прокаливание)
- Ca3(PO4)2 + 5C + 3SiO2 → 2P + 5CO + 3CaSiO3
- 2P + 5Cl2 → 2PCl5
- 8Ba(OH)2 + 2PCl5 → Ba3(PO4)2 + 5BaCl2 + 8H2O
Реальный ЕГЭ 2019 (резервные дни). Задание 32. Вариант 7.
К раствору сульфида аммония прибавили раствор сульфата железа(II). Выпавший осадок отделили, высушили, а затем сожгли в избытке кислорода, при этом образовался газ с резким запахом и твёрдый остаток. Газ пропустили через хлорную воду, а твёрдый остаток поместили в раствор, содержащий иодид калия и серную кислоту. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение- (NH4)2S + FeSO4 → FeS↓ + (NH4)2SO4
- 4FeS + 7O2 → 2Fe2O3 + 4SO2↑
- SO2 + Cl2 + 2H2O → H2SO4 + 2HCl
- Fe2O3 + 2KI + 3H2SO4 → I2 + 2FeSO4 + K2SO4 + 3H2O
Реальный ЕГЭ 2019 (резервные дни). Задание 32. Вариант 8.
Нитрат калия прокалили. При нагревании образовавшегося твёрдого остатка с бромидом аммония выделился газ, входящий в состав воздуха, и образовалась соль. Эту соль обработали концентрированной серной кислотой. При этом образовалось простое вещество красно-коричневого цвета. Это вещество прореагировало на холоду с раствором гидроксида натрия. Напишите уравнения четырёх описанных реакций.
Развернуть/свернуть решение- 2KNO3 → 2KNO2 + O2↑
- KNO2 + NH4Br → KBr + N2↑ + 2H2O
- 2KBr + 2H2SO4(конц.) → K2SO4 + Br2 + SO2↑ + 2H2O
- 2NaOH + Br2 → NaBrO + NaBr + H2O (на холоду)
Задание 33
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 1.
Развернуть/свернуть решение
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 2.
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 3.
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 4.
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 5.
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 6.
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 7.
Реальный ЕГЭ 2019 (резервные дни). Задание 33. Вариант 8.
Развернуть/свернуть решение
Задание 34
Реальный ЕГЭ 2019 (резервные дни). Задание 34. Вариант 1.
Водород объёмом 8,96 л (н.у.) пропустили при нагревании над порошком оксида меди(II), при этом водород прореагировал полностью. Полученный твёрдый остаток поместили в 510 г 20%-ного раствора нитрата серебра. Определите массовую долю соли в полученном растворе.
Развернуть/свернуть решениеЗаписаны уравнения реакций:
[1] CuO+ H2= Cu+ H2O [2] Cu+ 2AgNO3= Cu(NO3)2+ 2Ag↓Приведены необходимые вычисления:
n(H2) = 8,96 л / 22,4 л/моль = 0,4 моль
n(Cu) = n(H2) = 0,4 моль (по уравнению 1)
n(AgNO3) = 510 г ∙ 0,2 / 170 г/моль = 0,6 моль
Cu–в избытке, так как 0,4 / 1 = 0,4 (Cu), а 0,6 / 2 = 0,3 (AgNO3) (по уравнению 2)
n(Cu)прореаг.= 0,5n(AgNO3) = 0,5 * 0,6 моль = 0,3 моль (по уравнению 2)
m(Cu)прореаг= 0,3 моль ∙ 64 г/моль = 19,2 г
n(Ag) = n(AgNO3) = 0,6 моль (по уравнению 2)
m(Ag) = 0,6 моль ∙ 108 г/моль = 64,8 г
n(Cu(NO3)2) = 0,5n(AgNO3) = 0,5 * 0,6 моль = 0,3 моль (по уравнению 2)
m(Cu(NO3)2) = 0,3 моль ∙ 188 г/моль = 56,4 г
Найдена массовая доля соли в образовавшемся растворе:
m(конечного р-ра) = m(p-pa AgNO3) + m (прореаг. Cu) – m(Ag) = 510 г + 19,2 г –64,8 г = 464,4 г
w(Cu(NO3)2) = 56,4 г / 464,4 = 0,1214, или 12,14%
Ответ: 12,14%
Реальный ЕГЭ 2019 (резервные дни). Задание 34. Вариант 2.
Водород объёмом 6,72 л (н.у.) пропустили при нагревании над порошком оксида меди(II), при этом водород прореагировал полностью. В результате реакции получили 20,8 г твёрдого остатка. Этот остаток растворили в концентрированной серной кислоте массой 200 г. Определите массовую долю соли в полученном растворе.
Развернуть/свернуть решениеЗаписаны уравнения реакций:
[1] CuO + H2 → Cu + H2O (нагревание)Твердый остаток, состоящий из металлической меди и непрореагировавшего оксида меди (II), реагирует с концентрированной серной кислотой согласно уравнениям:
[2] Cu + 2H2SO4(конц.) → CuSO4 + SO2↑ + 2H2O [3] CuO + H2SO4 → CuSO4 + H2OПриведены необходимые вычисления:
Вычислим количество вещества водорода, участвовавшего в восстановлении оксида меди (II):
n(H2) = 6,72 л/22,4 л/моль = 0,3 моль,
n(H2) = n(Cu) = 0,3 моль (по уравнению 1)
m(Cu) = 0,3 моль · 64 г/моль = 19,2 г
Вычислим массу непрореагировавшего CuO, зная массу твердого остатка:
m(CuO)непрор = m(тв. ост.) – m(Cu) = 20,8 г – 19,2 г = 1,6 г
Вычислим количество и массу вещества непрореагировавшего оксида меди (II):
n(CuO)непрор = m(CuO) непрор/M(CuO) = 1,6 г/80 г/моль = 0,02 моль
n(Cu) = n1(CuSO4) = 0,3 моль (по уравнению 2)
n непрор(CuO) = n2(CuSO4) = 0,02 моль (по уравнению 3)
nобщ(CuSO4) = n1(CuSO4) + n2(CuSO4) = 0,3 моль + 0,02 моль = 0,32 моль.
mобщ.(CuSO4) = νобщ.(CuSO4) · M(CuSO4) = 0,32 моль · 160 г/моль = 51,2 г
Для того чтобы вычислить массу образовавшегося раствора, необходимо учесть массу оксида серы (IV), выделяющегося в реакции (2):
n(Cu) = n(SO2) = 0,3 моль (по уравнению 2)
m(SO2) = n(SO2) · M(SO2) = 0,3 моль · 64 г/моль = 19,2 г
Найдена массовая доля соли в образовавшемся растворе:
m(обр. р-ра) = m(тв. ост.) + m(р-ра H2SO4) – m(SO2) = 20,8 г + 200 г – 19,2 г = 201,6 г
ω(CuSO4) = m(CuSO4)/m(обр. р-ра) = 51,2 г/201,6 г · 100% = 0,254 или 25,4%
Ответ: 25,4%
Реальный ЕГЭ 2019 (резервные дни). Задание 34. Вариант 3.
Смешали 58,8 г 20%-ного раствора бромида аммония и 328 г 5%-ного раствора дигидрофосфата серебра. Выпавший осадок отделили, а к оставшемуся раствору добавили 34,2 г гидроксида бария и нагрели до прекращения выделения газа. Найдите массовую долю щелочи в образовавшемся растворе.
Развернуть/свернуть решениеЗаписаны уравнения реакций:
[1] NH4Br + AgH2PO4= AgBr↓+ NH4H2PO4 [2] 2NH4H2PO4+ 3Ba(OH)2= Ba3(PO4)2↓+ 2NH3↑+ 6H2O [3] 2NH4Br + Ba(OH)2= BaBr2+ 2NH3↑+ 2H2OПроизведены расчеты:
m(AgH2PO4) = 328 г · 0,05 = 16,4 г
n(AgH2PO4) = 16,4 г / 205 г/моль = 0,08моль
m(NH4Br исх.) = 58,8 г · 0,2 = 11,76 г
n(NH4Br исх.) = 11,76 г / 98 г/моль = 0,12моль – избыток по уравнению 1
n(AgBr) = n(AgH2PO4) = 0,08 моль (по уравнению 1)
m(AgBr) = 0,08 моль · 188 г/моль = 15,04 г
n(NH4H2PO4) = n(AgH2PO4) = 0,08 моль (по уравнению 1)
n(NH4Br прореаг.)= n(AgH2PO4)= 0,08 моль (по уравнению 1)
n(NH4Br ост.)= n(NH4Br исх.) – n(NH4Br прореаг.) = 0,12 моль –0,08 моль = 0,04 моль
n(Ba(OH)2исх.) = 34,2 г / 171 г/моль = 0,2моль – избыток по уравнению 2
n(Ba3(PO4)2) = 1/2n(NH4H2PO4) = 0,04 моль (по уравнению 2)
m(Ba3(PO4)2) = 0,04 моль · 601 г/моль = 24,04 г
n2 (NH3) = n(NH4H2PO4) = 0,08 моль (по уравнению 2)
m2 (NH3)= 0,08 моль · 17 г/моль = 1,36 г
n3 (NH3) = n(NH4Br ост.) = 0,04 моль (по уравнению 3)
m3 (NH3) = 0,04 моль · 17 г/моль = 0,68 г
n(Ba(OH)2 ост.) = n(Ba(OH)2 исх.) – n(Ba(OH)2 прореаг.) (после реакции 2)
n(Ba(OH)2 прореаг.) = 3/2n(NH4H2PO4) + 1/2n(NH4Br ост.) = 0,14 моль (по уравнению 2 и 3)
n(Ba(OH)2 ост.) = 0,2 моль – 0,14 моль = 0,06 моль
m(Ba(OH)2 ост.) = 0,06 моль · 171 г/моль = 10,26 г
m(р-ра конечного) = m(исх.р-ра NH4Br) + m(p-pa AgH2PO4) – m(AgBr) + m(доб. р-ра Ba(OH)2) – m(Ba3(PO4)2) – m2(NH3) – m3(NH3) = 58,8 г + 328 г –15,04 г + 34,2 г –24,04 г –1,36 г –0,68 г = 379,88 г
Определенамассовая доля щелочи в образовавшемся растворе:
ω(Ba(OH)2) = 10,26 г / 379, г = 0,027 или 2,7%
Ответ: 2,7%
Реальный ЕГЭ 2019 (резервные дни). Задание 34. Вариант 4.
Водород объёмом 3,36 л (н.у.) пропустили при нагревании над порошком оксида меди(II), при этом водород прореагировал полностью. В результате реакции получили 10,4 г твёрдого остатка. Этот остаток растворили в концентрированной серной кислоте массой 100 г. Определите массовую долю соли в полученном растворе.
Развернуть/свернуть решениеЗаписаны уравнения реакций:
[1] CuO + H2 → Cu + H2O (нагревание)Твердый остаток, состоящий из металлической меди и непрореагировавшего оксида меди (II), реагирует с концентрированной серной кислотой согласно уравнениям:
[2] Cu + 2H2SO4(конц.) → CuSO4 + SO2↑ + 2H2O [3] CuO + H2SO4 → CuSO4 + H2OПроизведены расчеты:
Вычислим количество и массу вещества водорода, участвовавшего в восстановлении оксида меди (II):
n(H2) = V(H2)/Vm = 3,36 л/22,4 л/моль = 0,15 моль,
n (H2) = n (Cu) = 0,15 моль (по уравнению 1)
m(Cu) = 0,15 моль · 64 г/моль = 9,6 г
Вычислим массу непрореагировавшего CuO, зная массу твердого остатка:
m(CuO) = m(тв. ост.) – m(Cu) = 10,4 г – 9,6 г = 0,8 г
Вычислим количество вещества и массу оксида меди (II):
n (CuO) = m(CuO)/M(CuO) = 0,8 г/80 г/моль = 0,01 моль
n (Cu) = n1 (CuSO4) = 0,15 моль (по уравнению 2)
n (CuO) = n2 (CuSO4) = 0,01 (по уравнению 3)
n общ.(CuSO4) = n1 (CuSO4) + n2 (CuSO4) = 0,15 моль + 0,01 моль = 0,16 моль.
mобщ.(CuSO4) = nобщ.(CuSO4) · M(CuSO4) = 0,16 моль · 160 г/моль = 25,6 г
Для того чтобы вычислить массу образовавшегося раствора, необходимо учесть массу диоксида серы, выделяющегося в реакции (II):
n (Cu) = n (SO2) = 0,15 моль (по уравнению 2)
m(SO2) = n (SO2) · M(SO2) = 0,15 моль · 64 г/моль = 9,6 г
Вычислим массу образовавшегося раствора:
m(р-ра) = m(тв. ост.) + m(р-ра H2SO4) – m(SO2) = 10,4 г + 100 г – 9,6 г = 100,8 г
Массовая доля сульфата меди (II) в образовавшемся растворе равна:
ω(CuSO4) = m(CuSO4)/m(р-ра) · 100% = 25,6 г/100,8 г · 100% = 25,4%
Ответ: 25,4%
Реальный ЕГЭ 2019 (резервные дни). Задание 34. Вариант 5.
Растворимость безводного сульфита аммония при некоторой температуре составляет 58 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество сульфита аммония к 120 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток концентрированной азотной кислоты. При этом выделился бурый газ. К раствору во второй колбе добавили 120 г раствора соляной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из второй колбы, оказался в 4 раза меньше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида аммония в конечном растворе во второй колбе.
Развернуть/свернуть решение1. Колба 1: (NH4)2SO3 + 2HNO3 → (NH4)2SO4 + 2NO2 + H2O (уравнение 1)
Колба 2: (NH4)2SO3 + 2HCl = 2NH4Cl + SO2↑ + H2O (уравнение 2)
- W(в-ва) = m(в-ва)/m(р-ра)
W(NH4Cl) = m(NH4Cl)/m(р-ра (NH4)2SO3 из колбы 2) + m(p-pa HCl) — m(SO2)
- Пусть х моль газа SO2 выделилось в колбе 2, тогда 4х моль газа NO2 выделилось в колбе 1 (по условию задачи).
- Используем пропорцию для решения задач на растворимость (если вы не знакомы с задачами на растворимость, то смотрите отдельную страницу «Задачи на растворимость» с подробными видео-объяснениями)
| Соль | Вода | Раствор | |
| Растворимость | 58 г | 100 г | |
| По условию задачи | y | 120 г |
Отсюда y = 58 г *120 г/100 г = 69,6 г ((NH4)2SO3 исходный или общий).
n = m/M, M((NH4)2SO3) = 116 г/моль, n((NH4)2SO3) = 69,6 г/116 г/моль = 0,6 моль
- n((NH4)2SO3) = 1/2n(NO2) = 2x моль (по уравнению 1)
n((NH4)2SO3) = n(SO2) = x моль (по уравнению 2)
2х + х = 0,6
3х = 0,6
х = 0,2
- n(NH4Cl) = 2n(SO2) = 2*х = 2*0,2 моль = 0,4 моль (по уравнению 2)
m = n*M, M(NH4Cl) = 53,5 г/моль, m(NH4Cl) = 0,4 моль*53,5 г/моль = 21,4 г
- n(SO2) = x = 0,2 моль
m = n*M, M(SO2) = 64 г/моль, m(SO2) = 0,2 моль*64 г/моль = 12,8 г
- n((NH4)2SO3 в колбе 2) = x = 0,2 моль
m = n*M, M((NH4)2SO3) = 116 г/моль, m((NH4)2SO3) = 0,2 моль*116 г/моль = 23,2 г
| Соль | Вода | Раствор | |
| Растворимость | 58 г | 100 г | 158 г |
| По условию задачи | 23,2 г | z |
Отсюда z = 23,2 г*158 г/58 г = 63,2 г (масса раствора (NH4)2SO3 во второй колбе)
- W(NH4Cl) = m(NH4Cl)/m(р-ра(NH4)2SO3 из колбы 2) + m(p-pa HCl) — m(SO2) = 21,4 г/63,2 г + 120 г — 12,8 г = 21,4 г/170,4 г = 0,126 или 12,6%
Также вы можете посмотреть видео-объяснение аналогичной задачи
Ответ: 12,6%
Реальный ЕГЭ 2019 (резервные дни). Задание 34. Вариант 6.
Оксид меди(II) массой 16 г нагрели в присутствии водорода объёмом 3,36 л (н.у.). При этом водород прореагировал полностью. Полученный твёрдый остаток растворили в 535,5 г 20%-ного раствора азотной кислоты, при этом наблюдали выделение бесцветного газа. Определите массовую долю азотной кислоты в образовавшемся растворе.
Развернуть/свернуть решениеЗаписаны уравнения реакций:
При пропускании водорода над оксидом меди (II) восстанавливается медь:
[1] CuO + H2 → Cu + H2O (нагревание)Твердый остаток, состоящий из металлической меди и оксида меди (II), реагирует с раствором азотной кислоты согласно уравнениям:
[2] 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O [3] CuO + 2HNO3 → Cu(NO3)2 + H2OПроизведены расчеты:
Вычислим количество вещества водорода и оксида меди (II), участвовавших в реакции (I):
n(H2) = V(H2)/Vm = 3,36 л/22,4 л/моль = 0,15 моль
n(CuO) = 16 г/80 г/моль = 0,2 моль
По уравнению реакции (I)
n(H2) = n(CuO) = 0,15 моль (по уравнению 1)
А по условию задачи водород прореагировал полностью, значит он в недостатке, что и подтверждают химические количества исходных веществ (0,15 моль H2 и 0,2 моль CuO), поэтому оксид меди (II) прореагировал не полностью.
Расчет ведем по недостатку вещества, следовательно, n(Cu) = n(H2) = 0,15 моль и nост.(CuO) = 0,2 моль – 0,15 моль = 0,05 моль.
Для расчета в дальнейшем массы раствора необходимо знать массы образовавшейся меди и непрореагировавшего оксида меди (II):
m(Cu) = n(Cu) · M(Cu) = 0,15 моль · 64 г/моль = 9,6 г
mост.(CuO) = n(CuO) · M(CuO) = 0,05 моль · 80 г/моль = 4 г
Общая масса твердого остатка равна: m(тв. ост.) = m(Cu) + mост.(CuO) = 9,6 г + 4 г = 13,6 г
Вычисли исходные массу и количества вещества азотной кислоты:
mисх.(HNO3) = m(р-ра HNO3) · ω(HNO3) = 535,5 г · 0,2 = 107,1 г
nисх.(HNO3) = mисх.(HNO3)/M(HNO3) = 107,1 г/63 г/моль = 1,7 моль
n2(HNO3) = 8/3n(Cu) (по уравнению 2)
n3(HNO3) = 2n(CuO) (по уравнению 3)
nобщ.(HNO3) = n2(HNO3) + n3(HNO3) = 8/3 · 0,15 моль + 2 · 0,05 мольмо = 0,5 моль.
Общая масса прореагировавшей в результате реакций 2 и 3 равна:
mобщ.(HNO3) = nобщ.(HNO3) · M(HNO3) = 0,5 моль · 63 г/моль = 31,5 г
Вычислим массу непрореагировавшей азотной кислоты:
mост.(HNO3) = mисх.(HNO3) – mобщ.(HNO3) = 107,1 г – 31,5 г = 75,6 г
Для того чтобы вычислить массу образовавшегося раствора, необходимо учесть массу оксида азота (II), выделяющегося в реакции (II):
n(NO) = 2/3n(Cu) (по уравнению 2)
n(NO) = 2/3 · 0,15 моль = 0,1 моль
m(NO) = n(NO) · M(NO) = 0,1 моль · 30 г/моль = 3 г
Найдена массовая доля кислоты в образовавшемся растворе:
Вычислим массу образовавшегося раствора:
m(р-ра) = m(тв. ост.) + m(р-ра HNO3) – m(NO) = 13,6 г + 535,5 г – 3 г = 546,1 г
Массовая доля азотной кислоты в образовавшемся растворе равна:
ω(HNO3) = mост.(HNO3)/m(р-ра) · 100% = 75,6 г/546,1 г · 100% = 13,84%
Ответ: 13,84%
Реальный ЕГЭ 2019 (резервные дни). Задание 34. Вариант 7.
Нитрид натрия массой 8,3 г растворили в 490 г 20%-ного раствора серной кислоты. К полученному раствору добавили 57,2 г кристаллической соды (Na2CO3∙10H2O).Определите массовую долю кислоты в конечном растворе. Учитывать образование только средних солей.
Развернуть/свернуть решениеНитрид натрия и разбавленная серная кислота реагируют с образованием двух средних солей – сульфатом аммония и натрия:
[1] 2Na3N + 4H2SO4 → 3Na2SO4 + (NH4)2SO4Вычислим количество вещества серной кислоты и нитрида натрия, реагирующих между собой:
mисх.(H2SO4) = m(р-ра H2SO4) · ω(H2SO4) = 490 г · 0,2 = 98 г, отсюда
nисх.(H2SO4) = mисх.(H2SO4)/M(H2SO4) = 98 г/98 г/моль = 1 моль
nисх.(Na3N) = mисх.(Na3N)/M(Na3N) = 8,3 г/83 г/моль = 0,1 моль
Вычислим количество непрореагировавшей по реакции 1 серной кислоты:
nост.1(H2SO4) = nисх.(H2SO4) — 2nисх.(Na3N) = 1 моль — 2 · 0,1 моль = 0,8 моль
Вычислим количество вещества кристаллической соды:
nисх.(Na2CO3 · 10H2O) = mисх.(Na2CO3 · 10H2O)/M(Na2CO3 · 10H2O) = 57,2 г/286 г/моль = 0,2 моль
Поскольку по условию задачи nост.1(H2SO4) = 3nисх.(Na2CO3 · 10H2O), т.е разбавленная серная кислота в избытке, следовательно, между этими веществами протекает следующая реакция:
[2] H2SO4 + Na2CO3 → Na2SO4 + CO2↑ + H2Onост.2(H2SO4) = nост.1(H2SO4) — nисх.(Na2CO3) = 0,8 моль — 0,2 моль = 0,6 моль
mост.2(H2SO4) = nост.2(H2SO4) · M(H2SO4) = 0,6 моль · 98 г/моль = 58,8 г
Для расчета в дальнейшем массы конечного раствора необходимо знать массы выделяющего по реакции (II) углекислого газа:
n(CO2) = n(Na2CO3) = 0,2 моль
m(CO2) = n(CO2) · M(CO2) = 0,2 моль · 44 г/моль = 8,8 г
Масса полученного раствора вычисляем по формуле равна:
m(р-ра) = mисх.(р-ра H2SO4) + mисх.(Na3N) + m(Na2CO3 · 10H2O) — m(CO2) = 490 г + 8,3 г + 57,2 г – 8,8 г = 546,7 г
Массовая доля серной кислоты равна:
ω ост.2(H2SO4) = m ост.2(H2SO4)/m(р-ра) · 100% = 58,8 г/546,7 г · 100% = 10,76%
Ответ: 10,76%
Реальный ЕГЭ 2019 (резервные дни). Задание 34. Вариант 8.
Оксид меди(II) массой 12 г нагрели в присутствии угарного газа объёмом 2,24 л (н.у.). При этом угарный газ прореагировал полностью. Полученный твёрдый остаток растворили в 126 г 85%-ного раствора азотной кислоты. Определите массовую долю азотной кислоты в образовавшемся растворе.
Развернуть/свернуть решениеПри пропускании водорода над оксидом меди (II) восстанавливается медь:
[1] CuO + CO → Cu + CO2 (нагревание)Вычислим количество вещества водорода, участвовавшего в восстановлении оксида меди (II):
nисх.(CO) = V(CO)/Vm = 2,24 л/22,4 л/моль = 0,1 моль,
nисх.(CuO) = 12 г/80 г/моль = 0,15 моль
nпрор(CuO) = n(CO) = n(Cu) = 0,1 моль (по уравнению 1)
Следовательно, образуется 0,1 моль меди и остается nост.(CuO) = nисх(CuO) — nпрор.(CuO) = 0,15 моль – 0,1 моль = 0,05 моль
Вычислим массы образовавшейся меди и непрореагировавшего оксида меди (II):
mост.(CuO) = nост.(CuO) · M(CuO) = 0,05 моль · 80 г/моль = 4 г
m(Cu) = n(Cu) · M(Cu) = 0,1 моль · 64 г/моль = 6,4 г
Твердый остаток, состоящий из металлической меди и непрореагировавшего оксида меди (II), реагирует с азотной кислотой согласно уравнениям:
[2] Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O [3] CuO + 2HNO3 → Cu(NO3)2 + H2OВычислим количество вещества азотной кислоты:
mисх.(HNO3) = m(р-ра HNO3) · ω(HNO3) = 126 г · 0,85 = 107,1 г, отсюда
nисх.(HNO3) = mисх.(HNO3)/M(HNO3) = 107,1 г/63 г/моль = 1,7 моль
n2(HNO3) = 4n(Cu) (по уравнению 2)
n3(HNO3) = 2nост.(CuO) (по уравнению 3)
nобщ.(HNO3) = n2(HNO3) + n3(HNO3) = 4 · 0,1 моль + 2 · 0,05 моль = 0,5 моль.
Вычислим общую массу азотной кислоты, реагирующей по реакциям 2 и 3:
mобщ.(HNO3) = nобщ.(HNO3) · M(HNO3) = 0,5 моль · 63 г/моль = 31,5 г
Вычислим массу непрореагировавшей азотной кислоты:
mост.(HNO3) = mисх.(HNO3) — mобщ.(HNO3) = 107,1 г – 31,5 г = 75,6
Для того чтобы вычислить массу образовавшегося раствора, необходимо учесть массу оксида азота (IV), выделяющегося в реакции 2:
n(NO2) = 2m(Cu) = 0,2 моль (по уравнению 2)
m(NO2) = n(NO2) · M(NO2) = 0,2 моль · 46 г/моль = 9,2 г
Вычислим массу образовавшегося раствора:
m(р-ра) = m(р-ра HNO3) + m(Cu) + m(CuO) — m(NO2) = 126 г + 6,4 г + 4 г — 9,2 г = 127,2 г
Массовая доля азотной кислоты в образовавшемся растворе равна:
ω(HNO3) = mост.(HNO3)/m(р-ра) · 100% = 75,6 г/127,2 г · 100% = 59,43%
Ответ: 59,43%
Задание 35
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 1.
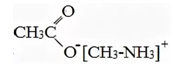
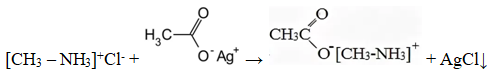
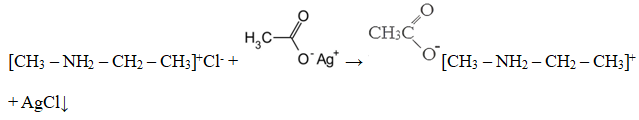
При взаимодействии соли первичного амина с ацетатом серебра образуется органическое вещество А и хлорид серебра. Вещество А содержит 15,38% азота, 35,16% кислорода и 9,90% водорода по массе. Напишите уравнение реакции получения вещества А взаимодействием соли первичного амина и ацетата серебра.
Развернуть/свернуть решениеМассовая доля углерода в веществе А составляет 100% — 15,38% — 35,16% — 9,9% = 39,56%
Найдем соотношение химических количеств углерода, водорода, азота и кислорода.
Примем массу соединения А за 100 г, тогда m (C) = 39,56 г, m (H) = 9,9 г, m (N) = 15,38 г, m (O) = 35,16 г, а химические количества элементов следующие:
n(С) = 39,56 г / 12 г/моль = 3,3 моль
n(H) = 9,9 г / 1 г / моль = 9,9 моль
n(N) = 15,38 г / 14 г/моль = 1,1 моль
n(О) = 35,16 г / 16 г/моль = 2,2 моль
Соотношение химических количеств углерода к водороду к азоту и к кислороду, как 3,3 : 9,9 : 1,1 : 2,2 = 3 : 9 : 1 : 2. Следовательно, молекулярная формула вещества А – C3H9NO2.
Так как вещество А получено из соли первичного амина по реакции с ацетатом серебра, то в его состав входит ацетат ион CH3COO—, значит на остаток (катион) первичного амина приходится СH6N (C3H9NO2 – C2H3O2).
Структурная формула вещества А:
Уравнение реакции, описанной в условии задачи:
Также допускается запись:
[CH3 – NH3]+Cl— + CH3COOAg → [CH3 – NH3]+ CH3COO— + AgCl↓
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 2.
При сжигании образца органического вещества массой 9,52 г получено 24,64 г углекислого газа и 5,04 г воды. Данное вещество подвергается гидролизу под действием гидроксида натрия с образованием двух солей. Напишите уравнение гидролиза данного вещества в присутствии гидроксида натрия.
Развернуть/свернуть решениеИсходное органическое вещество точно содержит в своём составе углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M
M(CO2) = 44 г/моль, М(Н2О) = 18 г/моль
n (CO2) = 24,64 г/44 г/моль = 0,56 моль
n (С) = n (СО2) = 0,56 моль
m (C) = 0,56 моль ∙ 12 г/моль = 6,72 г
n (H2O) = 5,04 г / 18 г/моль = 0,28 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,28 моль = 0,56 моль
m (H) = 0,56 моль ∙ 1 г/моль = 0,56 г
m (C) + m (H) = 6, 72 г + 0,56 г = 7,28 г, что НЕ равно массе исходного вещества, а значит там есть кислород.
m (O) = m (в-ва) – m (C+H) = 9,52 г – 7,28 г = 2,24 г
n (O) = 2,24 г / 16 г/моль = 0,14 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 0,56 : 0,56 : 0,14 = 4 : 4 : 1
Следовательно простейшая формула вещества: C4H4O.
Щелочному гидролизу с образованием солей, как правило, подвергаются вещества, содержащие сложноэфирные связи. Поэтому предполагаем, что исходное органическое соединение – это сложный эфир. Но в сложных эфирах должно быть как минимум два атома кислорода, поэтому необходимо удвоить индексы в простейшей формуле.
Значит молекулярная формула вещества: C8H8O2.
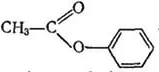
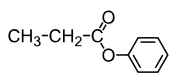
Но так как образуются две соли, а не одна, то можно предположить, что этот эфир ообразован не остатком спирта и карбоновой кислоты, а остатком фенола и карбоновой кислоты.
Значит структурная формула вещества:
Уравнение реакции, описанной в условии задачи:
CH3COOC6H5 + 2NaOH ↔ CH3COONa + C6H5ONa + H2O
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 3.
При сгорании 21,6 г органического вещества нециклического строения получили 70,4 г углекислого газа и 21,6 г воды. Известно, что при присоединении 1 моль хлороводорода к 1 моль этого вещества преимущественно образуется соединение, содержащее атом хлора у первичного атома углерода. Напишите уравнение реакции данного вещества с хлороводородом.
Развернуть/свернуть решениеИсходное органическое вещество точно содержит в своём составе углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M
M(CO2) = 44 г/моль, М(Н2О) = 18 г/моль
n (CO2) = 70,4 г/44 г/моль = 1,6 моль
n (С) = n (СО2) = 1,6 моль
m (C) = 1,6 моль ∙ 12 г/моль = 19,2 г
n (H2O) = 21,6 г / 18 г/моль = 1,2 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 1,2 моль = 2,4 моль
m (H) = 2,4 моль ∙ 1 г/моль = 2,4 г
m (C) + m (H) = 19,2 г + 2,4 г = 21,6 г, что и равно массе исходного вещества, а значит кислорода нет.
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) = 1,6 : 2,4 = 1 : 1,5 = 2 : 3
Следовательно простейшая формула вещества: C2H3.
Но вещества с такой формулой не существует (убедиться в этом вы можете попробовав нарисовать структурную формулу и тогда у углерода не будет соблюдаться валентность IV).
Значит индексы в простейшей формуле ещё раз надо удвоить.
Следовательно молекулярная формула вещества: C4H6.
Что соответствует углеводородам с общей формулой CnH2n-2. А значит это может быть алкин или алкадиен (циклические соединения не рассматриваем, так как в условии задачи сказано, что строение нециклическое). Но если предположить, что это бутин, то по правилу Марковникова при присоединении к 1 моль бутина 1 моль хлороводорода будет образовываться 2-хлорбутен-1 или 2-хлорбутен-2, т.е. хлор будет находиться у вторичного атома углерода, что НЕ соответствует условию задачи.
Значит делаем вывод, что исхлдное органическое вещество – это бутадиен. Но так как надо получить продукт, содержащий атом хлора у первичного атома, делаем вывод, что диен должен быть сопряжённый, так как только у сопряжённого бутадиена-1,3 преимущественно наблюдается 1,4-присоединение (при соотношении 1 моль бутадиена-1,3 и 1 моль хлороводорода).
Следовательно структурная формула исходного вещества:
СН2 = СН – СН = СН2
Уравнение реакции, описанной в условии задачи:
СН2 = СН – СН = СН2 + HCl → CH2Cl – CH = CH – CH3
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 4.
При взаимодействии соли вторичного амина с ацетатом серебра образуется органическое вещество А и йодид серебра. Вещество А содержит 45,71% углерода, 10,48% водорода и 30,48% кислорода по массе. Напишите уравнение реакции получения вещества А взаимодействием соли вторичного амина и ацетата серебра.
Развернуть/свернуть решениеВ веществе А также есть атомы азота, так как оно получилось из соли амина, в состав которого входил азот.
Массовая доля азота в веществе А составляет 100% — 45,71% — 10,48% — 30,48% = 13,33%
Найдем соотношение химических количеств углерода, водорода, азота и кислорода.
Примем массу соединения А за 100 г, тогда m (C) = 45,71 г, m (H) = 10,48 г, m (N) = 13,33 г, m (O) = 30,48 г, а химические количества элементов следующие:
n(С) = 45,71 г / 12 г/моль = 3,81 моль
n(H) = 10,48 г / 1 г / моль = 10,48 моль
n(N) = 13,33 г / 14 г/моль = 0,95 моль
n(О) = 30,48 г / 16 г/моль = 1,905 моль
Соотношение химических количеств углерода к водороду к азоту и к кислороду, как 3,81 : 10,48 : 0,95 : 1,905 = 4 : 11 : 1 : 2. Следовательно, молекулярная формула вещества А – C4H11NO2.
Так как вещество А получено из соли вторичного амина по реакции с ацетатом серебра, то в его состав входит ацетат ион CH3COO—, значит на остаток (катион) вторичного амина приходится С2H8N (C4H11NO2 – C2H3O2).
Структурная формула вещества А:
Уравнение реакции, описанной в условии задачи:
Также допускается запись:
[CH3 – NH2 – СН3]+I— + CH3COOAg → [CH3 – NH2 – СН3]+CH3COO— + AgI↓
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 5.
При сжигании образца органического вещества массой 16,32 г получено 21,5 л (н.у.) углекислого газа и 8,64 г воды. Данное вещество подвергается гидролизу под действием гидроксида калия с образованием двух солей. Напишите уравнение гидролиза данного вещества в присутствии гидроксида калия.
Развернуть/свернуть решениеИсходное органическое вещество точно содержит в своём составе углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M, n = V/Vm.
n (CO2) = 21,5 л/22,4 л/моль = 0,96 моль
n (С) = n (СО2) = 0,96 моль
m (C) = 0,96 моль ∙ 12 г/моль = 11,52г
n (H2O) = 8,64 г / 18 г/моль = 0,48 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,48 моль = 0,96 моль
m (H) = 0,96 моль ∙ 1 г/моль = 0,96 г
m (C) + m (H) = 11,52 г + 0,96 г = 12,48 г, что НЕ равно массе исходного вещества, а значит там есть кислород.
m (O) = m (в-ва) – m (C+H) = 16,32 г – 12,48 г = 3,84 г
n (O) = 3,84 г / 16 г/моль = 0,24 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 0,96 : 0,96 : 0,24 = 4 : 4 : 1
Следовательно простейшая формула вещества: C4H4O.
Щелочному гидролизу с образованием солей, как правило, подвергаются вещества, содержащие сложноэфирные связи. Поэтому предполагаем, что исходное органическое соединение – это сложный эфир. Но в сложных эфирах должно быть как минимум два атома кислорода, поэтому необходимо удвоить индексы в простейшей формуле.
Значит молекулярная формула вещества: C8H8O2.
Но так как образуются две соли, а не одна, то можно предположить, что этот эфир ообразован не остатком спирта и карбоновой кислоты, а остатком фенола и карбоновой кислоты.
Значит структурная формула вещества:
Уравнение реакции, описанной в условии задачи:
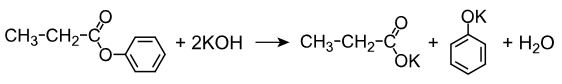
CH3COOC6H5 + 2KOH ↔ CH3COOK + C6H5OK + H2O
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 6.
При взаимодействии соли вторичного амина с ацетатом серебра образуется органическое вещество А и хлорид серебра. Вещество А содержит 50,43% углерода, 11,76% азота и 26,89% кислорода по массе. Напишите уравнение реакции получения вещества А взаимодействием соли вторичного амина и ацетата серебра.
Развернуть/свернуть решениеВ веществе А также есть атомы водорода, так как водород входит в состав всех органических веществ.
Массовая доля азота в веществе А составляет 100% — 50,43% — 11,76% — 26,88% = 10,93%
Найдем соотношение химических количеств углерода, водорода, азота и кислорода.
Примем массу соединения А за 100 г, тогда m (C) = 50,43 г, m (H) = 10,93 г, m (N) = 11,76 г, m (O) = 26,89 г, а химические количества элементов следующие:
n(С) = 50,43 г / 12 г/моль = 4,2 моль
n(H) = 10,93 г / 1 г / моль = 10,93 моль
n(N) = 11,76 г / 14 г/моль = 0,84 моль
n(О) = 26,89 г / 16 г/моль = 1,68 моль
Соотношение химических количеств углерода к водороду к азоту и к кислороду, как 4,2 : 10,93 : 0,84 : 1,68 = 5 : 13 : 1 : 2. Следовательно, молекулярная формула вещества А – C5H13NO2.
Так как вещество А получено из соли вторичного амина по реакции с ацетатом серебра, то в его состав входит ацетат ион CH3COO—, значит на остаток (катион) вторичного амина приходится С3H10N (C5H13NO2 – C2H3O2).
Структурная формула вещества А:
Уравнение реакции, описанной в условии задачи:
Также допускается запись:
[CH3 – NH2 – СН2 – СН3]+Cl— + CH3COOAg → [CH3 – NH2 – СН2 – СН3]+CH3COO— + AgCl↓
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 7.
При сжигании образца органического вещества А получено 4,48 л (н.у.) углекислого газа, 1,44 г воды и 12,96 г бромоводорода. Данное вещество А может быть получено присоединением избытка брома к соответствующему углеводороду Б. Также известно, что при бромировании этого углеводорода Б в условиях недостатка брома возможно образование структурных изомеров. Напишите уравнение реакции получения данного вещества А взаимодействием соответствующего углеводорода Б с избытком брома.
Развернуть/свернуть решениеn (CO2) = V (CO2) / Vm = 4,48 л / 22,4 л/моль = 0,2 моль
n (C) = n (CO2) = 0,2 моль.
n (H2O) = m (H2O) / M (H2O) = 1,44 г / 18 г/моль = 0,08 моль.
n (HBr) = m (HBr) / M (HBr) = 12,96 г / 81 г/моль = 0,16 моль, тогда:
n (H) = 2 ∙ n (H2O) + n (HBr) = 2∙0,08 + 0,16 = 0,32 моль
n (Br) = n (HBr) = 0,16 моль.
Поскольку вещество А может быть получено присоединением брома к углеводороду Б, очевидно, что вещество А кислород не содержит и его общая формула может быть записана как CxHyBrz. Тогда:
x : y : z = 0,2 : 0,32 : 0,16 = 1,25 : 2 : 1 = 5 : 8 : 4
Таким образом, молекулярная формула вещества А – C5H8Br4.
В таком случае исходный углеводород Б, очевидно, имеет формулу C5H8.
Данная молекулярная формула вписывается в гомологический ряд соединений с общей формулой CnH2n-2.
Такую формулу могут иметь алкины и алкадиены. Вариант с алкином отпадает, т.к. при частичном бромировании алкинов образование структурных изомеров невозможно.
Таким образом, наиболее вероятен в качестве решения алкадиен. При этом одновременно подходят три алкадиена:
пентадиен-1,4: CH2=CH-CH2-СН=СН2
пентадиен-1,3: CH2=CH-CH=CH-СН3
пентадиен-1,2: CH2=C=CH-CH2-СН3
По всей видимости, авторы задания подразумевали все-таки пентадиен-1,3, способный к 1,2- и 1,4-присоединению при взаимодействии с галогеном в соотношении 1:1.
В таком случае уравнение получения вещества А присоединением избытка брома к соответствующему углеводороду будет иметь вид:
Реальный ЕГЭ 2019 (резервные дни). Задание 35. Вариант 8.
При сжигании образца органического вещества массой 12 г получено 31,68 г углекислого газа и 7,2 г воды. Данное вещество подвергается гидролизу под действием гидроксида калия с образованием двух солей. Напишите уравнение гидролиза данного вещества в присутствии гидроксида калия.
Развернуть/свернуть решениеИсходное органическое вещество точно содержит в своём составе углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M
M(CO2) = 44 г/моль, М(Н2О) = 18 г/моль
n (CO2) = 31,68 г/44 г/моль = 0,72 моль
n (С) = n (СО2) = 0,72 моль
m (C) = 0,72 моль ∙ 12 г/моль = 8,64 г
n (H2O) = 7,2 г / 18 г/моль = 0,4 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,4 моль = 0,8 моль
m (H) = 0,8 моль ∙ 1 г/моль = 0,8 г
m (C) + m (H) = 8,64 г + 0,8 г = 9,44 г, что НЕ равно массе исходного вещества, а значит там есть кислород.
m (O) = m (в-ва) – m (C+H) = 12 г – 9,44 г = 2,56 г
n (O) = 2,56 г / 16 г/моль = 0,16 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 0,72 : 0,8 : 0,16 = 4,5 : 5 : 1 = 9 : 10 : 2
Значит молекулярная формула вещества: C9H10O2.
Но так как образуются две соли, а не одна, то можно предположить, что этот эфир ообразован не остатком спирта и карбоновой кислоты, а остатком фенола и карбоновой кислоты.
Значит структурная формула вещества:
Уравнение реакции, описанной в условии задачи:
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку

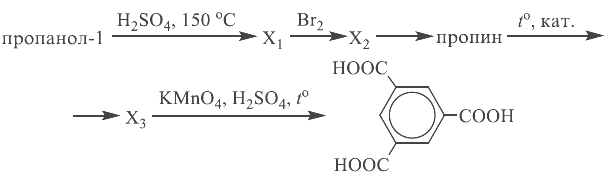

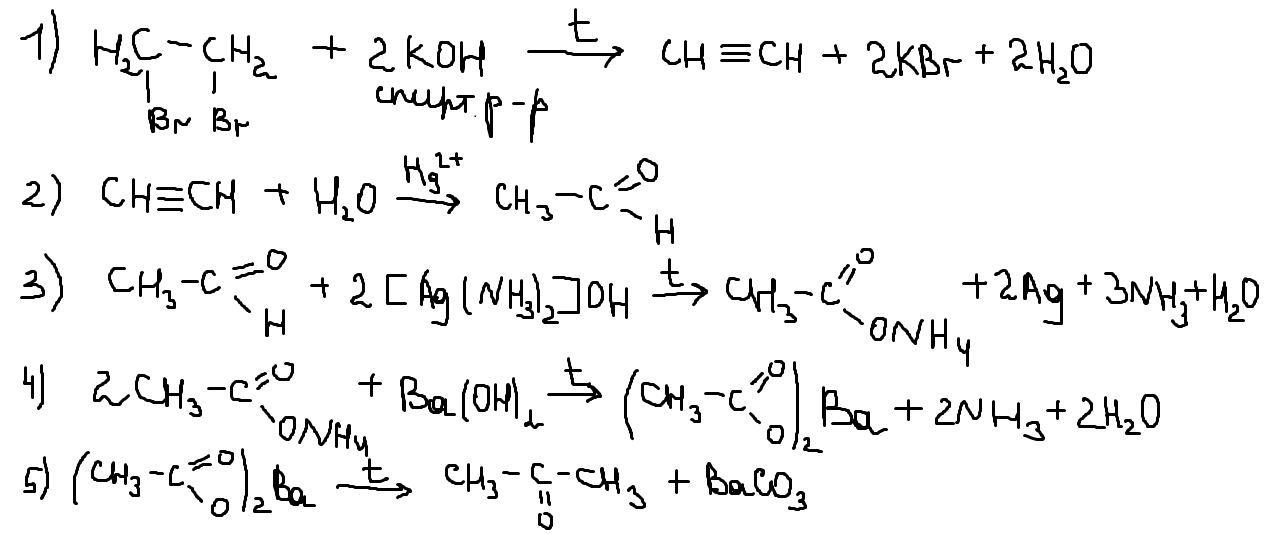
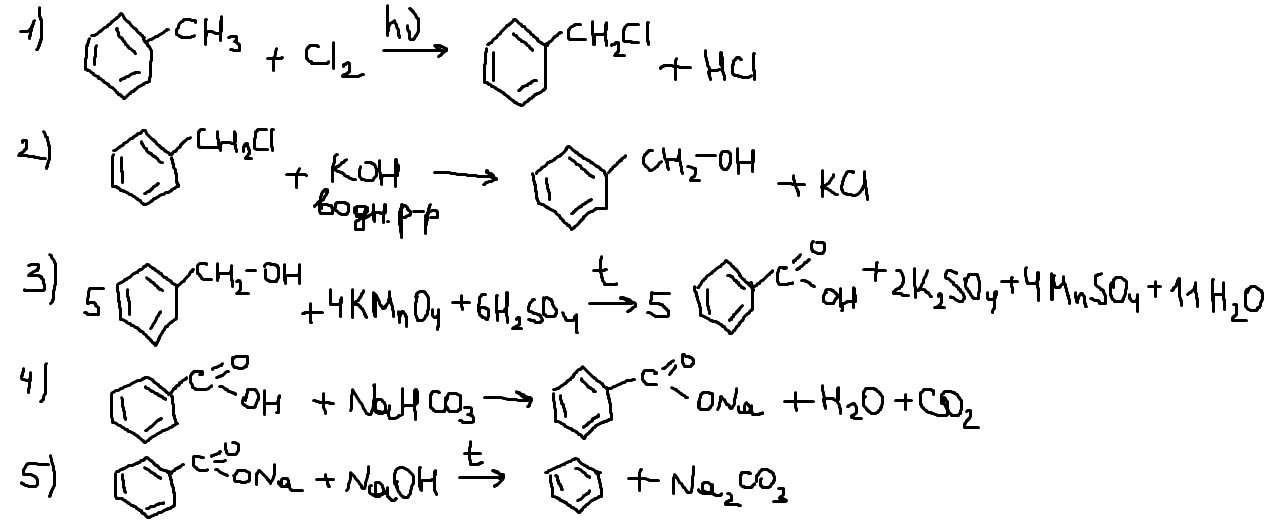



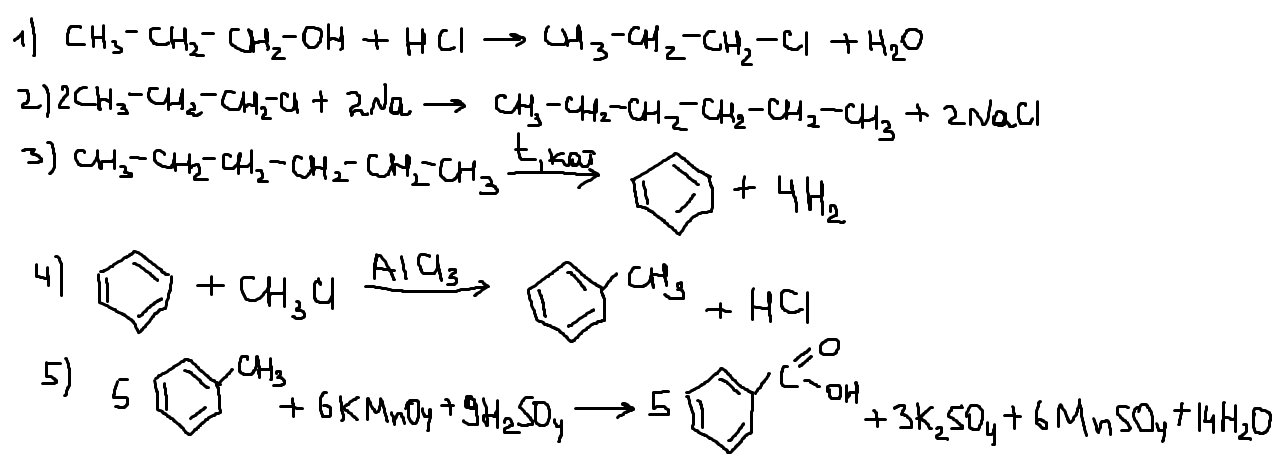

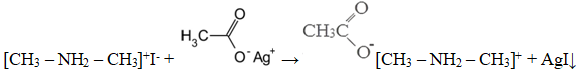
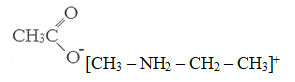
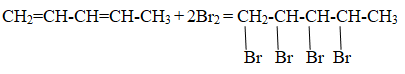
В зад 34 вар 8 в условии 16 г оксида меди, а в расчете — 12 г. Поэтому либо ответ неверный, либо в условии ошибка.
Ошибка все же присутствует, ведь если мы считаем хим. количество исходного оксида меди 2, то стоит взять массу за 16 г.
Да и в случае избытка, он бы прореагировал с азотной кислотой, так как по условию в растворе после реакций все еще присутствует азотная кислота.
Здравствуйте. Я понял в чём причина, там была банальная опечатка. В условии должно быть 12 г оксида меди, а не 16. Опечатку уже устранил