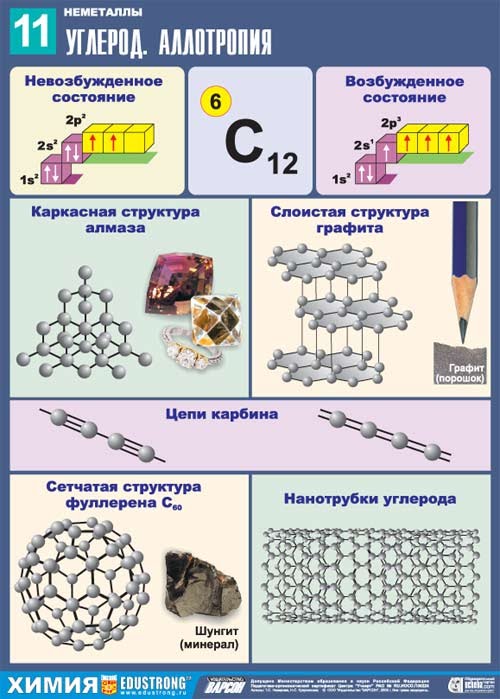
Углерод встречается в природе, как в свободном виде, так и в соединениях. В свободном виде встречается в виде аллотропных видоизменений – алмаз, графит, карбин, фуллерен.
Алмаз
Кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не проводит электрический ток, плохо проводит тепло, ρ = 3,5 г/см3; t°пл. = 3730°C; t°кип. = 4830°C.
Можно получить из графита при p > 50 тыс. атм; t° = 1200°C.
Применение:
Шлифовальный порошок, буры, стеклорезы, после огранки — бриллианты.
Графит
Кристаллическое вещество, слоистое, непрозрачное, тёмно-серое, обладает металлическим блеском, мягкое, проводит электрический ток; ρ = 2,5 г/см3.
Применение:
Электроды, карандашные грифели, замедлитель нейтронов в ядерных реакторах, входит в состав некоторых смазочных материалов.
Карбин
Чёрный порошок; ρ = 2 г/см3; полупроводник.
Состоит из линейных цепочек –C≡C–C≡C– и =С=С=С=С=.
При нагревании переходит в графит.
В конце 80-х годов XX века было обнаружено ещё одно аллотропное видоизменение – фуллерит. Он, в отличие от алмаза и графита, имеет не атомную, а молекулярную кристаллическую решётку.
Атомы углерода могут образовывать также полые трубки – так называемые нанотрубки. В настоящее время фуллерены и нанотрубки рассматриваются в качестве основы для технологий будущего.
Соединения углерода весьма распространены: все живые организмы, каменный уголь, торф, нефть и др. содержат углерод. Углерод входит в состав многих неорганических веществ (известняк, мел, мрамор и др).
ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕРОДА
Углерод — малоактивен, на холоде реагирует только со фтором; химическая активность проявляется при высоких температурах.
|
С – восстановитель С0 – 4 е—→ С+4 или С0 – 2 е—→ С+2 |
С – окислитель С0 + 4 е—→ С-4 |
| 1) с кислородом
C0 + O2 t˚C → CO2 углекислый газ при недостатке кислорода наблюдается неполное сгорание образуется угарный газ: 2C0 + O2 t˚C → 2C+2O 2) со фтором С + 2F2 → CF4 3) с водяным паром C0 + H2O t˚C → С+2O + H2 водяной газ 4) с оксидами металлов С + MexOy = CO2 + Me C0 + 2CuO t˚C → 2Cu + C+4O2 5) с кислотами – окислителями: C0 + 2H2SO4(конц.) → С+4O2 + 2SO2 + 2H2O С0 + 4HNO3(конц.) → С+4O2 + 4NO2 + 2H2O
|
1) с некоторыми металлами образует карбиды
4Al + 3C0 t˚C → Al4C3-4 Ca + 2C0 t˚C → CaC2-1 2) с водородом C0 + 2H2 t˚C → CH4
|
Оксид углерода(II) – СО
(угарный газ, окись углерода, монооксид углерода)
Физические свойства: бесцветный ядовитый газ без вкуса и запаха, горит голубоватым пламенем, легче воздуха, плохо растворим в воде. Концентрация угарного газа в воздухе 12,5—74 % взрывоопасна.
Строение молекулы:
Формальная степень окисления углерода +2 не отражает строение молекулы СО, в которой помимо двойной связи, образованной обобществлением электронов С и О, имеется дополнительная, образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода (изображена стрелкой):
В связи с этим молекула СО очень прочна и способна вступать в реакции окисления-восстановления только при высоких температурах. При обычных условиях СО не взаимодействует с водой, щелочами или кислотами.
Получение:
Основным антропогенным источником угарного газа CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Угарный газ образуется при сгорании топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления угарного газа CO в углекислый газ CO2). В естественных условиях, на поверхности Земли, угарный газ CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров.
1) В промышленности (в газогенераторах)
C + O2 = CO2 + 402 кДж
CO2 + C = 2CO – 175 кДж
В газогенераторах иногда через раскалённый уголь продувают водяной пар:
С + Н2О = СО + Н2 – Q,
смесь СО + Н2 – называется синтез – газом.
2) В лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
HCOOH t˚C, H2SO4 → H2O + CO
H2C2O4 t˚C,H2SO4→ CO + CO2 + H2O
Химические свойства:
При обычных условиях CO инертен; при нагревании – восстановитель;
CO — несолеобразующий оксид.
1) с кислородом
2C+2O + O2 t˚C → 2C+4O2↑
2) с оксидами металлов CO + MexOy = CO2 + Me
C+2O + CuO t˚C → Сu + C+4O2↑
3) с хлором (на свету)
CO + Cl2 свет → COCl2 (фосген – ядовитый газ)
4)* реагирует с расплавами щелочей (под давлением)
CO + NaOH P → HCOONa (формиат натрия)
Влияние угарного газа на живые организмы:
Угарный газ опасен, потому что он лишает возможности кровь нести кислород к жизненно важным органам, таким как сердце и мозг. Угарный газ объединяется с гемоглобином, который переносит кислород к клеткам организма, в следствии чего тот становится непригодным для транспортировки кислорода. В зависимости от вдыхаемого количества, угарный газ ухудшает координацию, обостряет сердечно-сосудистые заболевания и вызывает усталость, головную боль, слабость, Влияние угарного газа на здоровье человека зависит от его концентрации и времени воздействия на организм. Концентрация угарного газа в воздухе более 0,1% приводит к смерти в течение одного часа, а концентрация более 1,2% в течении трех минут.
Применение оксида углерода:
Главным образом угарный газ применяют, как горючий газ в смеси с азотом, так называемый генераторный или воздушный газ, или же в смеси с водородом водяной газ. В металлургии для восстановления металлов из их руд. Для получения металлов высокой чистоты при разложении карбонилов.
Оксид углерода (IV) СO2 – углекислый газ
Физические свойства: Углекислый газ, бесцветный, без запаха, растворимость в воде — в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO2 называется «сухой лёд»); не поддерживает горение.
Строение молекулы:
Углекислый газ имеет следующие электронную и структурную формулы —
Все четыре связи ковалентые полярные.
Получение:
1. Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка – в промышленности:
CaCO3 t=1200˚C→ CaO + CO2
2. Действием сильных кислот на карбонаты и гидрокарбонаты –
в лаборатории:
CaCO3 (мрамор) + 2HCl → CaCl2 + H2O + CO2
NaHCO3 + HCl → NaCl + H2O + CO2
3. Сгорание углеродсодержащих веществ:
СН4 + 2О2 → 2H2O + CO2
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
Химические свойства:
Кислотный оксид:
1) с водой даёт непрочную угольную кислоту:
СО2 + Н2О ↔ Н2СО3
2) реагирует с основными оксидами и основаниями, образуя соли угольной кислоты
Na2O + CO2 → Na2CO3
2NaOH + CO2 → Na2CO3 + H2O
NaOH + CO2 (избыток) → NaHCO3
3) При повышенной температуре может проявлять окислительные свойства – окисляет металлы — СO2 + Me = MexOy + C
С+4O2 + 2Mg t˚C→ 2Mg+2O + C0
Качественная реакция на углекислый газ:
Помутнение известковой воды Ca(OH)2 за счёт образования белого осадка – нерастворимой соли CaCO3:
Ca(OH)2 + CO2 → CaCO3 ↓+ H2O
Угольная кислота и её соли
Химическая формула — H2CO3
Структурная формула – все связи ковалентные полярные:
Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
CO2 + H2O ↔ H2CO3
Химические свойства:
Для угольной кислоты характерны все свойства кислот.
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор — лакмус краснеет в водном растворе:
H2CO3 ↔ H+ + HCO3—(гидрокарбонат-ион)
HCO3— ↔ H+ + CO32- (карбонат-ион)
2) с активными металлами
H2CO3 + Ca = CaCO3 + H2↑
3) с основными оксидами
H2CO3 + CaO = CaCO3 + H2O
4) с основаниями
H2CO3(изб) + NaOH = NaHCO3 + H2O
H2CO3 + 2NaOH = Na2CO3 + 2H2O
5) Очень непрочная кислота – разлагается
Соли угольной кислоты – карбонаты и гидрокарбонаты
Угольная кислота образует два ряда солей:
· Средние соли — карбонаты Na2СO3, (NH4)2CO3
· Кислые соли — бикарбонаты, гидрокарбонаты NaHCO3 , Ca(HCO3)2
В природе встречаются:
CaCO3 мел, мрамор, известняк
NaHCO3 – питьевая сода
K2CO3(поташ, в золе растений)
Na2CO3 – сода, кальцинированная сода
Na2CO3 x 10H2O – кристаллическая сода
Физические свойства:
Все карбонаты – твёрдые кристаллические вещества. Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
2) Разложение гидрокарбонатов при нагревании
NaHCO3 t˚C → Na2CO3 + H2O + CO2↑
3) Разложение нерастворимых карбонатов при нагревании
CaCO3 t˚C → CaO+ CO2↑
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
гидрокарбонаты в карбонаты
Me(HCO3)n + Me(OH)n → MeCO3+H2O
Me(HCO3)n t˚C → MeCO3↓+H2O+CO2↑
карбонаты в гидрокарбонаты
MeCO3+H2O+CO2= Me(HCO3)n
Специфические свойства:
1) Качественная реакция на CO32- карбонат – ион «вскипание» при действии сильной кислоты:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑