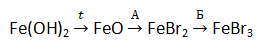Предлагаем вашему вниманию восьмой пробный вариант для подготовки к ЦТ по химии 2021: видео-объяснения даны сразу после каждого задания, а текстовые ответы представлены в конце страницы.
Скачать РТ 2020/2021 вариант 8 (аналог 3 этапа РТ 2020/2021)
ВНИМАНИЕ: все задания составлены автором самостоятельно и не являются копией заданий ЦТ и РТ. Если вам необходимы оригинальные задания, то вам надо записываться на этапы РТ (на сайте РИКЗ) и покупать сборники реальных заданий ЦТ и РТ в книжных магазинах.
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
Вариант 8
Для получения полного доступа к сайту переходите по ссылке: http://www.yoursystemeducation.com/poluchit-video/. В полном доступе вы найдёте условия и видео-объяснения заданий-аналогов из всех этапов РТ начиная с 2014 года, а также всех заданий-аналогов ЦТ начиная с самого первого ЦТ 2004 года.
Вариант содержит 44 задания и состоит из части А (28 заданий) и части В (16 заданий). На выполнение всего теста отводится 150 минут. Необходимые справочные материалы – «Периодическая система химических элементов Д.И. Менделеева», «Растворимость кислот, оснований и солей в воде», Электрохимический ряд активности металлов» — приведены в конце теста.
При расчётах принять молярный объём газа (Vm) 22,4 дм3/моль. Значения относительных атомных масс химических элементов (кроме хлора, для которого Ar = 35,5) следует округлять до целого числа. При решении заданий можно пользоваться микрокалькулятором.
А1. Число электронов в атоме численно совпадает с:
1) числом вакантных орбиталей
2) суммарным количеством протонов и нейтронов в ядре
3) порядковым номером элемента
4) количеством электронов на первом энергетическом уровне
5) числом электронных слоёв
А2. Укажите верное утверждение для атома, электронно-графическая схема которого представлена на рисунке:
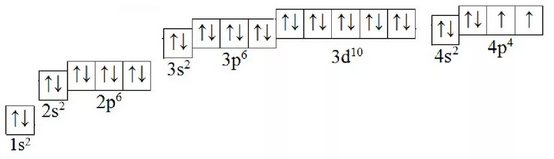 1) содержит 8 энергетических уровней
1) содержит 8 энергетических уровней
2) содержит 7 завершённых подуровня
3) число валентных электронов равно 2
4) находится в возбуждённом состоянии
5) до полного завершения четвёртого уровня не хватает 2 электрона
А3. В ряду элементов Mg, Al, B, C последовательно:
1) уменьшается численное значение электроотрицательности
2) уменьшаются окислительные свойства атомов
3) сначала усиливаются, а затем ослабевают неметаллические свойства
4) понижается значение высшей валентности в оксида, образованных атомами этих элементов
5) уменьшается размер атмов
А4. Укажиет ряд молекул, в которых последовательно увеличивается число электронов, учавствующих в образовании всех ковалентных связей:
1) хлор, азот, кислород
2) фтороводород, аммиак, этен
3) иод, ацетилен, иодоводород
4) серная кислота, фосфин, селеноводород
5) хлорид фосфора (V), метан, хлорид фосфора (III)
А5. Укажите общее число веществ, в которых хром имеет одинаковую степень окисления – Cr2(SO4)3, (NH4)2Cr2O7, Cr2O3, NaCrO2, Na3[Cr(OH)6], Cr(OH)2:
1) 1
2) 2
3) 3
4) 4
5) 5
А6. Укажите тип кристаллической решётки вещества, которое является твёрдым при н.у., является хрупким, не имеет блеска, имеет высокую температуру плавления, растворяется в воде, его расплав и раствор проводят электрический ток:
1) атомная
2) ионная
3) металлическая
4) молекулярная с водородными связями между молекулами
5) молекулярная с водородными связями внутри молекул
А7. Укажите массу (г) атомов кислорода в навеске горькой соли (MgSO4∙7H2O) количеством 0,2 моль:
1) 3,2
2) 6,4
3) 12,8
4) 35,2
5) 49,2
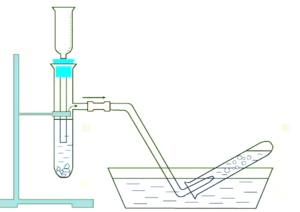
А8. Укажите газ, который НЕцелесообразно получать и собирать, используя прибор, показанный на рисунке:
2) водород
3) метан
4) оксид азота (II)
5) силан
А9. Число оксидов среди – флюорит, магнетит, кварц, угарный газ, веселящий газ, негашёная известь – равно:
1) 1
2) 2
3) 3
4) 4
5) 5
А10. Укажите металл, при добавлении которого к водному раствору CuSO4 образуется осадок, состоящий из нескольких сложных веществ:
1) ртуть
2) свинец
3) железо
4) никель
5) стронций
А11. Укажите пару веществ, при взаимодействии которых образуется фосфорная кислота:
1) K3PO4 и H2SiO3
2) Ca3(PO4)2 и H2S
3) P2O5 и H2O
4) CaHPO4 и P2O5
5) Na2HPO4 и NaOH
А12. Укажите вещества А и Б соответственно в схеме превращений
2) NaBr и Br2
3) Br2 и HBr
4) SrBr2 и HBr
5) HBr и KBr
А13. Бром как ХИМИЧЕСКИЙ ЭЛЕМЕНТ:
1) является жидким (при н.у.) и ядовитым веществом
2) при растворении в воде образует бромную воду
3) взаимодействует с цинком с образованием бромида
4) содержится в составе солей в морской воде
5) взаимодействут с алканами
А14. Укажите верное утверждение об веществе, формула которого NH3:
1) окисляется кислородом воздуха без катализатора до азота
2) газ, имеющий резкий запах и бурый цвет при н.у.
3) получают разложением нитрата аммония
4) применяют в производстве спичек
5) реакция среды его водного раствора слабокислая
А15. Активированный уголь употребляют при отравлениях, так как он:
1) является слабым окислителем
2) не проводит электрический ток
3) реагирует с кислородом
4) является катализатором
5) обладает сорбционной способностью
А16. Водород образуется при растворении алюминия при комнатной температуре в растворе:
1) H2SO4 (конц.)
2) CaCl2
3) NaOH
4) HNO3 (разб.)
5) CuSO4
А17. Одно и то же цинкосодержащее вещество образуется в результате превращений пары:
1) ZnO + NaOH (р-р, изб) → и ZnO + H2SO4 (р-р, изб) →
2) Zn + Ba(OH)2 (р-р, изб) → и Zn(OH)2 + Ba(OH)2 (р-р, изб) →
3) ZnO + NaOH (р-р, изб) → и ZnO + NaOH (тв) → (нагревание)
4) Zn(NO3)2 (изб) + Ca(OH)2 (р-р) → и ZnBr2 + Ca(OH)2 (р-р, изб) →
5) ZnCl2 + KOH (р-р, изб) → и ZnCl2 (изб) + NH3 + H2O →
А18. Укажите формулу сильного электролита:
1) H2S
2) C2H5OH
3) CH3COONa
4) HClO
5) NH3∙H2O
А19. В водный раствор соляной кислоты, содержащий 36,5 г кислоты, добавили фенолфталеин. Окраска индикатора изменится после добавления в этот раствор 1 моль:
1) NH3
2) AgNO3
3) NaOH
4) H2SO4
5) Ba(OH)2
А20. Окислительно-восстановительная реакция возможна между:
1) CaO и SO3
2) NO2 и CO2
3) Li2O и P2O5
4) SrO и SiO2
5) FeO и CO
А21. Модели молекул углеводородов, которые вступают в реакции присоединения:
А22. В схеме превращений ![]() , вещества Х и Y являются соответственно:
, вещества Х и Y являются соответственно:
1) CH4 и CH3CH2Cl
2) C2H6 и CH2=CHCl
3) CaC2 и CH(Cl)2CH3
4) C2H6 и CH2(Br)CH2 Cl
5) CH4 и CH(Cl)=CH Cl
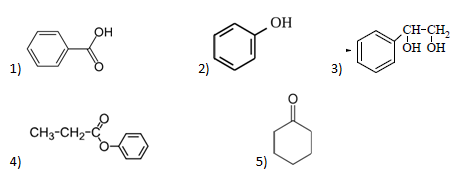
А23. Укажите гомолог 3-метилфенола:
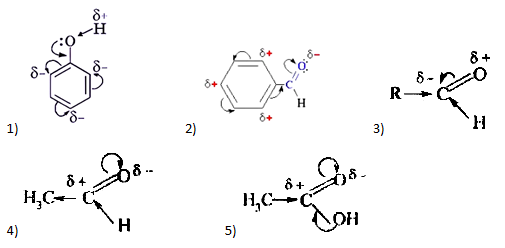
А24. Укажите рисунок, на котором верно показано распределение электронной плотности в молекуле альдегида:
А25. Сумма молярных масс (г/моль) органического вещества Х и вещества немолекулярного строения Y схемы превращений
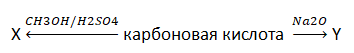 равна 180 г/моль. Укажите название карбоновой кислоты:
равна 180 г/моль. Укажите название карбоновой кислоты:
1) 2-метилпропановая кислота
2) уксусная кислота
3) муравьиная кислота
4) пропионовая кислота
5) акриловая кислота
А26. Качественной реакцией на альдегидную группу в глюкозе является реакция с:
1) оксидом меди (I)
2) оксидом меди (II)
3) бромной водой
4) серебром
5) гидроксидом меди (II), 20С
А27. Укажите число веществ из указанных – HCl (p-p), C2H5CH(NH2)COOH, C2H2, AgCl, CH3CH(OH)CH3, – которые реагируют с глицином:
1) 1
2) 2
3) 3
4) 4
5) 5
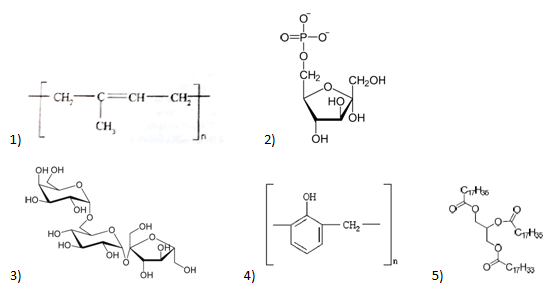
А28. Укажите формулу высокомолекулярного соединения, которое получают по реакции поликонденсации:
Часть В
В1. Установите соответствие между формулой органического вещества и числом его структурных изомеров.
| ФОРМУЛА | ЧИСЛО СТРУКТУРНЫХ ИЗОМЕРОВ |
| А) C4H10
Б) C4H8 В) C2H7N Г) C3H7OH |
1
2 3 4 5 |
Ответ запишите в виде сочетания букв и цифр, например: А2Б2В5Г3 (цифры могут повторяться).
В2. Выберите четыре верных утверждения.
- Толуол и стирол относятся к одному гомологическому ряду.
- В результате гидрирования этилбензола образуется гептан.
- Метан является основным компонентом природного газа.
- Стирол принадлежит к гомологическому ряду с общей формулой CnH2n-8.
- Арены могут вступать в реакции замещения и присоединения.
- При тримеризации этина получают бензол.
В3. ![]() Выберите реагенты для осущуествления превращений, представленных выше (соли находятся в виде разбавленных водных растворов):
Выберите реагенты для осущуествления превращений, представленных выше (соли находятся в виде разбавленных водных растворов):
1) нитрат калия;
2) оксид азота (IV);
3) нитрат серебра (I);
4) цинк/соляная кислота (изб.);
5) азотная кислота/серная кислота;
6) гидроксид калия (р-р);
7) нитрат аммония.
Ответ запишите в виде сочетания букв и цифр, например: А1Б2В5Г3.
В4. Вычислите суммарную массу (г) азотсодержащего вещества Х и вещества Y, имеющего немолекулярное строение, которые получены из двух одинаковых порций этиленгликоля по 15,5 г каждая:
В5. 127,44 кг полихлоропрена получили по схеме:
 Вычислите массу (кг) 2-хлорбутана, пошедшего на получения заданной массы полимера.
Вычислите массу (кг) 2-хлорбутана, пошедшего на получения заданной массы полимера.
В6. Определите сумму молярных масс (г/моль) натрийсодержащего вещества В и серодсодержащего вещества Е, в котором массовая доля серы равна 26,7%:
В7. Укажите соответствие между реагирующими веществами и сокращённым ионным уравнением реакции (электролиты представлены разбавленными водными растворами).
| А) Cu(OH)2 + HNO3 →
Б) CuCl2 + K2S → В) H2S + Cu(OH)2 → Г) Cu(NO3)2 + Na2S → Д) CuSO4 + LiOH → |
1. Cu2+ + S2- → CuS
2. H2S + Cu2+ →2H+ + CuS 3. 2H+ + Cu(OH)2 → 2H2O + Cu2+ 4. Cu(OH)2 + H2S →CuS + 2H2O 5. Cu2+ + 2OH— → Cu(OH)2 |
Ответ запишите в виде сочетания букв и цифр, например: А2Б2В5Г3Д1 (цифры могут повторяться).
В8. Установите соответствие между парой веществ и реактивом, с помощью которого можно определить каждое вещество из пары (электролиты представлены разбавленными водными растворами).
| А) HCl и CH3COOH
Б) (HCOO)2Pb и BaBr2 В) ZnSO4 и NH4HSO4 Г) Na2S и Na2SO3 |
1. HBr
2. KOH 3. NaF 4. NH4HCO3 5. LiNO3 |
Ответ запишите в виде сочетания букв и цифр, например: А2Б2В5Г3.
В9. Установите соответствие между схемой реакции и смещением равновесия при увеличении объёма реакционной смеси.
| А) Br2 (ж) + H2 (г) ↔ 2HBr (г)
Б) H2 (г) + Se (к)↔ H2Se (г) В) SO2 (г) + Cl2 (г) ↔ SO2Cl2 (ж) Г) NH3 (г) + HCl (г)↔ NH4Cl (тв) |
1. Практически не смещается
2. Смещается вправо 3. Смещается влево |
Ответ запишите в виде сочетания букв и цифр, например: А2Б2В5Г3 (цифры могут повторяться).
В10. Простое вещество А твёрдое при н.у. и имеет белый цвет с желтоватым оттенком. Вещество А окисляется кислородом на воздухе, излучая видимый свет. При поджигании в кислороде образуется вещество Б с образованием белого густого дыма. Вещество Б отлично реагирует с водой с образованием вещества В, которое изменяет окраску водного раствора лакмуса на красную. Вещество А при нагревании с калием образует бинарное соединение Г, которое легко гидролизуется водой с образованием бесцветного газа Д, который нельзя получить прямым взаимодействием простых веществ. Также известно, что вещества Б и В по отдельности могут реагировать с водным раствором гидрофосфата натрия образуя другую кислую соль Е. Установите соответствие между зашифрованным веществом и его молярной массой (г/моль).
| А
Б В Г Д Е |
1. 142
2. 148 3. 120 4. 124 5. 34 6. 98 |
Ответ запишите в виде сочетания букв и цифр, например: А2Б4В5Г3Д1Е6.
В11. Установите соответствие между формулой удобрения и его названием.
| А. NH4H2PO4 + (NH4)2HPO4 + KNO3
Б. K2CO3 В. Ca(H2PO4)2 + CaSO4 Г. NaNO3 Д. CO(NH2)2 |
1) суперфосфат
2) чилийская селитра 3) мочевина 4) аммофоска 5) поташ |
Ответ запишите в виде сочетания букв и цифр, например: А1Б2В5Г3Д4.
В12. Рассчитайте объём (см3) раствора серной кислоты с молярной концентрацией 0,4 моль/дм3, необходимого для полной нейтрализации раствора едкого кали объёмом 1372,55 см3 (плотность 1,02 г/см3) с массовой долей щёлочи 0,08%.
В13. Имеется газообразная смесь алкена и сероводорода, в которой соотношение газов 1 : 5 по объёму соответственно. Эту смесь сожгли в избытке кислорода. Продукты сжигания полностью поглотили избытком раствора гидроксида стронция, в результате чего образовался осадок массой 128,4 г. Затем путём определённых реакций весь сульфит стронция, содержащийся в осадке, перевели в сульфат и полученную смесь обработали избытком бромоводородной кислоты. Масса твёрдого остатка после растворения в кислоте составила 92 г. Укажите относительную молекулярную массу исходного алкена.
В14. При взаимодействии избытка халькогена с водородом объёмом 67,2 дм3 (н.у.) образовался халькогеноводород. Вычислите массу (г) халькогена, вступившего в реакцию, если массовая доля халькогена в халькогеноводороде равна 94,12%.
В15. Растворимость соли KAl(SO4)2 составляет 71 г на 100 г воды при определённой температуре. Рассчитайте объём воды (см3), который необходимо взять для приготовления насыщенного раствора этой соли объёмом 330 см3 с плотностью 1,2 г/см3 при данной температуре.
В16. Смесь массой 9,84 г, состоящей из серебра и меди, полностью растворили в избытке концентрированной азотной кислоты. После чего к полученному раствору добавили избыток раствора сульфида натрия, в результате чего выпал осадок массой 14 г. Определите массовую долю (%) меди в исходной смеси металлов.
Ответы:
Часть А
- 3
- 2
- 5
- 2
- 4
- 2
- 4
- 1
- 5
- 5
- 3
- 1
- 4
- 1
- 5
- 3
- 2
- 3
- 5
- 5
- 1
- 5
- 2
- 2
- 5
- 3
- 3
- 4
Часть В
- А2Б5В2Г3
- 3456
- А5Б4В3Г6
- 59
- 185
- 299
- А3Б1В4Г1Д5
- А4Б3В2Г1
- А2Б1В3Г3
- А4Б1В6Г2Д5Е3
- А4Б5В1Г2Д3
- 25
- 42
- 96
- 232
- 78
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
Составитель — репетитор по химии в Skype или Zoom — Александр Владимирович Коньков (подробнее здесь)
Посмотреть видео-объяснения каждого задания ЦТ, РТ и ДРТ всех лет вы можете получив полный доступ к сайту кликнув здесь «Получить все материалы сайта»
- Посмотреть все пробные варианты ЦТ 2021 вы можете здесь, нажав на эту строку
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку
- Больше заданий РТ вы можете найти здесь, нажав на эту строку
- Больше заданий ЦТ вы можете найти здесь, нажав на эту строку
- Наш канал на YouTube вы можете посмотреть, нажав на эту строку