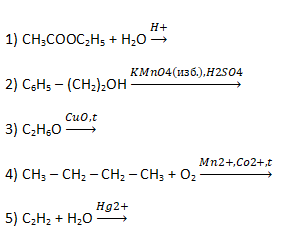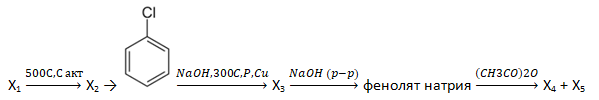Скачать Пробный вариант 5. ЕГЭ 2020 по химии с ответами в формате pdf
Вариант 5
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
1) Ar; 2) Be; 3) He; 4) Fe; 5) Xe.
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
- Определите, атомы каких из указанных элементов в основном состоянии имеют наименьшее отношение числа нейтронов к массовому числу. Запишите в поле ответа номера выбранных элементов.
- Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе и подгруппе. Расположите выбранные элементы в порядке увеличения их атомного радиуса. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
- Из числа указанных в ряду элементов выберите два элемента, которые могут проявлять в соединениях степень окисления +2. Запишите в поле ответа номера выбранных элементов.
- Из предложенного перечня выберите два вещества, которые тугоплавки и не проводят ток ни в твёрдом виде, ни в расплаве.
1) P2O5
2) C
3) Si
4) W
5) NaBr
Запишите в поле ответа номера выбранных веществ.
- Установите соответствие между тривиальным названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА |
| А) ляпис | 1) соли средние |
| Б) гашёная известь | 2) оксиды кислотные |
| В) кварц | 3) оксиды основные |
| 4) основания |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует калий и кальций по отдельности.
1) вода
2) твёрдый гидроксид натрия при сплавлении
3) твёрдый гидроксид цинка при сплавлении
4) азот при нагревании
5) оксид серы (IV)
Запишите в поле ответа номера выбранных веществ.
- К веществу Х добавили соль Y, в результате чего протекала химическая реакция, которую можно описать с помощью сокращённого ионного уравнения: Al3+ + 3OH— = Al(OH)3. Из предложенного перечня выберите вещества Х и Y, которые могут вступать в описанную реакцию (с учётом избытка и условий).
1) раствор гидроксида калия (избыток)
2) раствор гидроксида натрия
3) расплав гидроксида натрия (избыток)
4) раствор хлорида алюминия (избыток)
5) расплав хлорида алюминия
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
- Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) Ba | 1) NaOH, H2O, Na2SO4 |
| Б) Cr2O3 | 2) N2, H2O, O2 |
| В) Zn(OH)2 | 3) CsOH, RbOH, HI |
| Г) NH4Cl | 4) Na2CO3, Hg, AgI |
| 5) AgNO3, NaOH, Ba(OH)2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
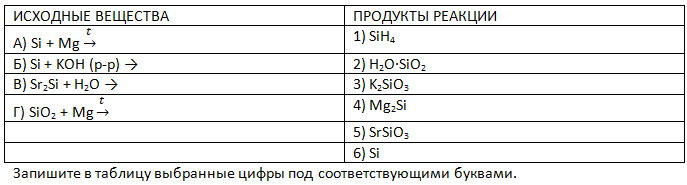
- Установите соответствие между исходными веществами, вступающими в реакцию, и кремнийсодержащими продуктами, которые образуются в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) AsH3
2) Na3AsO4
3) H3AsO4
4) BaO
5) BaCO3
Запишите в таблицу номера веществ под соответствующими буквами.
- Установите соответствие между формулой вещества и его названием: к каждой позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | НАЗВАНИЕ ВЕЩЕСТВА |
 |
1) 2-метилбутан
2) лактоза 3) фенол 4) сахароза |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два рисунка, которые верно отображают электронное строение и распределение электронной плотности в карбоксильной группе.
Запишите в поле ответа номера выбранных рисунков.
- Из предложенного перечня выберите два ряда веществ, в которых каждое из веществ реагирует с бензолом.
1) Br2 (FeBr3), O2
2) H2O, KMnO4 (p-p)
3) Br2 (CCl4), H2
4) HNO3 (конц. H2SO4), KCl (p-p)
5) C2H4 (AlCl3), CH3Cl (AlCl3)
Запишите в поле ответов номера выбранных рядов веществ.
- Из предложенного перечня выберите две схемы реакций, в результате которых в лаборатории можно получить альдегид.
Запишите в поле ответа номера выбранных схем реакций.
- Из предложенного перечня выберите два вещества, которые образуются при гидролизе трипальмитата избытком раствора гидроксида калия.
1) C3H8O3
2) C17H33COOH
3) C15H31COOK
4) C17H31COOK
5) C15H31COOH
Запишите в поле ответа номера выбранных веществ.
- Установите соответствие между химическим процессом и органическим веществом, которое является продуктом в этом процессе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ХИМИЧЕСКИЙ ПРОЦЕСС | ПРОДУКТ |
| А) дегидроциклизация гептана | 1) ацетон |
| Б) алкилирование бензола | 2) 2,2-диметилбутан |
| В) изомеризация гептана | 3) 2-метилгексан |
| Г) гидратация пропина | 4) бензол |
| 5) толуол | |
| 6) пропанол-2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
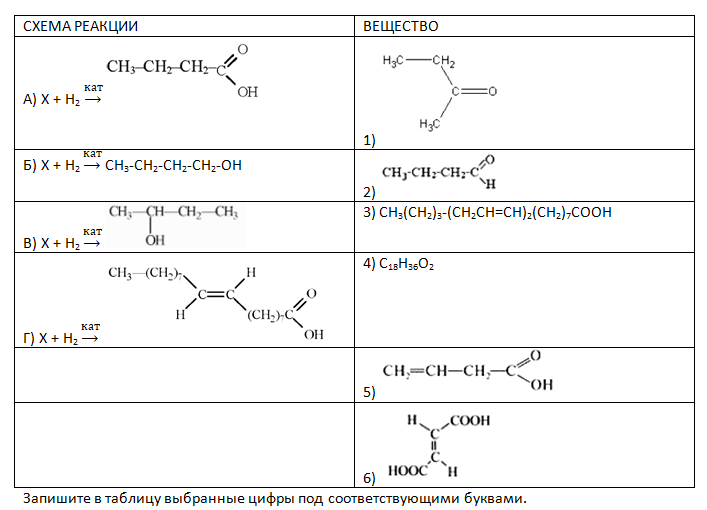
- Установите соответствие между схемой реакции гидрирования и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) уксусная кислота
2) муравьиная кислота
3) метилацетат
4) гидрокарбонат натрия
5) нитрат натрия
Запишите в таблицу номера веществ под соответствующими буквами.
- Из предложенного перечня типов реакций выберите два типа реакций, к которым можно отнести реакцию сжигания метана.
1) экзотермическая
2) эндотермическая
3) обратимая
4) каталитическая
5) гомогенная
Запишите в поле ответа номера выбранных типов реакций.
- Из предложенного перечня выберите два внешних воздействия, которые приводят к уменьшению скорости реакции Zn(тв.) + 2H+ = Zn2+ +H2(г.) + Q.
1) увеличение концентрации ионов водорода
2) увеличение давления
3) увеличение концентрации ионов цинка
4) повышение температуры
5) испарение воды
Запишите в поле ответа номера выбранных внешних воздействий.
- Установите соответствие между схемой окислительно восстановительной реакции и суммой коэффициентов в уравнении этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ РЕАКЦИИ | СУММА КОЭФФИЦИЕНТОВ |
| А) Fe + Cl2 → | 1) 3 |
| Б) Cl2 + CO → | 2) 4 |
| В) NaI + Br2 → | 3) 6 |
| 4) 7 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названием соли и продуком, образующимся на инертном аноде при электролизе её водного раствора:к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | ПРОДУКТ НА АНОДЕ |
| А) нитрат никеля (II) | 1) S |
| Б) хлорат калия | 2) SO2 |
| В) бромид лития | 3) Cl2 |
| Г) хлорид цезия | 4) O2 |
| 5) H2 | |
| 6) Br2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между формулой соли и средой водного раствора этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
| А) C17H35COOK | 1) кислая |
| Б) (HCOO)2Ca | 2) нейтральная |
| В) NH4NO3 | 3) щелочная |
| Г) CuCl2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между уравнением обратимой реакции и факторами, повышающими выход продуктов реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | ФАКТОРЫ, ПОВЫШАЮЩИЕ ВЫХОД ПРОДУКТА |
| А) 2SO3 (г) ↔ 2SO2 (г) + O2 (г) – Q | 1) понижение давления и нагревание |
| Б) 2HCl (г) + O2 (г)↔ 2Cl2 (г) + 2H2O (ж) – Q | 2) понижение давления и охлаждение |
| В) N2 (г) + 3H2 (г)↔ 2NH3 (г) + Q | 3) повышение давления и нагревание |
| Г) FeO (тв) + H2 (г) ↔ Fe (тв) + H2O (ж) – Q | 4) повышение давления и охлаждение |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между двумя ионами, находящимися в разных пробирках, и реактивом, с помощью которого можно различить эти ионы: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИОНЫ | РЕАКТИВ |
| А) Zn2+ и Al3+ | 1) Li+ |
| Б) SiO32- и S2- | 2) OH— |
| В) Fe2+ и Fe3+ | 3) Ca2+ |
| Г) PO43- и SO32- | 4) F— |
| 5) Na+ |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между веществом/сплавом и сырьём для его промышленного получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО/СПЛАВ | СЫРЬЁ ДЛЯ ПОЛУЧЕНИЯ |
| А) чугун | 1) азотная кислота, оксид азота (IV) |
| Б) сталь | 2) железная руда, кокс, флюсы |
| В) аммиак | 3) чугун, железный лом |
| 4) азот (из воздуха), водород (из метана) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Вычислите растворимость сульфата калия (в граммах на 100 г воды) при 10С, если массовая доля этой соли в насыщенном растворе при данной температуре составляет 8,44%. (Запишите число с точностью до сотых.)
- Какой объём кислорода потребуется для полного сжигания 11,2 л пропина? Объёмы газов измерены в одинаковых условиях. (Запишите число с точностью до десятых.)
- Вычислите массу углекислого газа (в граммах), который образуется при полном сжигании угарного газа химическим количеством 5 моль. (Запишите число с точностью до целых.)
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
хлор, гидроксид натрия, оксид кальция, фосфат натрия, сульфат хрома (III), серная кислота. Допустимо использование водных растворов веществ.
- Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора на жёлтый. Выделение осадка или газа в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
- Из предложенного перечня веществ выберите две соли, которые вступают в реакцию ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
- К раствору сульфата цинка добавили избыток раствора гидроксида калия. В полученный раствор по каплям приливали разбавленную азотнуб кислоту, при этом наблюдали образование студенистого осадка белого цвета, который растворился при дальнейшем прибавлении кислоты. Из полученного раствора выделили цинкосодержащий продукт, высушили и прокалили. Напишите уравнения четырёх описанных реакций.
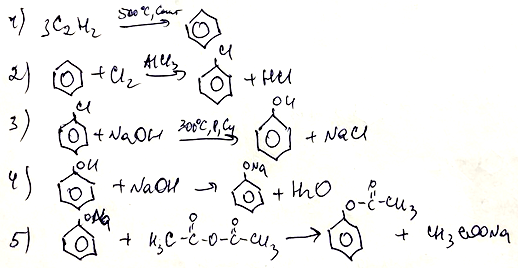
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
- Смешали 42,75 г технического сульфата алюминия, содержащего 20% нерастворимых примесей, и 42,4 г карбоната натрия. Полученную смесь растворили в воде массой 200 г. Определите массовую долю сульфата натрия в образовавшемся растворе, если реакция протекает с выходом 90%. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических венличин).
- При сгорании 69 г органического вещества получили 89,6 л углекислого газа (н.у.) и 45 г воды. Это вещество можно получить мягким окислением ароматического углеводорода водным раствором перманганата калия на холоду.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение получения этого вещества окислением ароматического углеводорода водным раствором перманганата калия (используйте структурные формулы органических веществ).
Система оценивания экзаменационной работы по химии
Часть 1
За правильный ответ на каждое из заданий 1–6, 11–15, 19–21, 26–29 ставится 1 балл.
Задание считается выполненным верно, если экзаменуемый дал правильный ответ в виде последовательности цифр или числа с заданной степенью точности.
Задания 7–10, 16–18, 22–25 считаются выполненными верно, если правильно указана последовательность цифр.
За полный правильный ответ заданий 7–10, 16–18, 22–25 ставится 2 балла; если допущена одна ошибка – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
| Номер задания | Правильный ответ |
| 1 | 34 |
| 2 | 315 |
| 3 | 24 |
| 4 | 12 |
| 5 | 142 |
| 6 | 14 |
| 7 | 24 |
| 8 | 2335 |
| 9 | 4316 |
| 10 | 34 |
| 11 | 341 |
| 12 | 34 |
| 13 | 15 |
| 14 | 35 |
| 15 | 13 |
| 16 | 5531 |
| 17 | 5213 |
| 18 | 14 |
| 19 | 15 |
| 20 | 35 |
| 21 | 413 |
| 22 | 4463 |
| 23 | 3311 |
| 24 | 1343 |
| 25 | 4121 |
| 26 | 234 |
| 27 | 9,22 |
| 28 | 44,8 |
| 29 | 220 |
Часть 2
Критерии оценивания заданий с развёрнутым ответом
За выполнение заданий 30, 31 ставится от 0 до 2 баллов; задания 35 – от 0 до 3 баллов; заданий 32 и 34 – от 0 до 4 баллов; задания 33 – от 0 до 5 баллов.
Задание 30
Вариант ответа:
Cr2(SO4)3 + 3Cl2 + 16NaOH→2Na2CrO4 + 6NaCl + 3Na2SO4 + 8H2O
3 Cl20 + 2ē → 2Cl-1
1 2Cr+3 – 6ē → 2Cr+6
Сульфат хрома (III) или хром в степени окисления +3 является восстановителем.
Хлор – окислителем.
Задание 31
Вариант ответа:
2Na3PO4 + Cr2(SO3)3 = 2CrPO4 + 3Na2SO4
6Na+ + 2PO43- + 2Cr3+ + 3SO42- = 2CrPO4 + 6Na+ + 3SO42-
Cr3+ + PO43- = CrPO4
Задание 32
Вариант ответа:
ZnSO4 + 4KOH = K2SO4 + K2[Zn(OH)4]
K2[Zn(OH)4] + 2HNO3 = 2KNO3 + Zn(OH)2 + 2H2O
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
2Zn(NO3)2 = 2ZnO + 4NO2 + O2
Задание 33
Примечание. Допустимо использование структурных формул разного вида (развёрнутой, сокращённой, скелетной), однозначно отражающих порядок связи атомов и взаимное расположение заместителей и функциональных групп в молекуле органического вещества.
Задание 34
Объяснение этой задачи вы можете найти на Ютуб по ссылке
Ответ: 15,3%
Задание 35
Исходное органическое вещество точно содержит в своём составе углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = m/M, m = n ∙ M, n = V/Vm.
n (CO2) = 89,6 л/22,4 л/моль = 4 моль
n (С) = n (СО2) = 4 моль
m (C) = 4 моль ∙ 12 г/моль = 48 г
n (H2O) = 45 г / 18 г/моль = 2,5 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 2,5 моль = 5 моль
m (H) = 5 моль ∙ 1 г/моль = 5 г
m (C) + m (H) = 48 г + 5 г = 53 г, что НЕ равно массе исходного вещества, а значит там есть кислород.
m (O) = m (в-ва) – m (C+H) = 69 г – 53 г = 16 г
n (O) = 16 г / 16 г/моль = 1 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 4 : 5 : 1
Следовательно простейшая формула вещества: C4H5O.
Но так как в условии сказано, что исходное вещество получается мягким окислением ароматического УВ водным раствором перманганата калия, то значит исходное вещество должно содержать бензольное кольцо (так как при мягком окислении не наблюдается разрыва цикла). Следовательно, простейшую формулу необходимо удвоить.
Молекулярная формула C8H10O2.
При мягком окислении кратных связей между атомами углерода образуются многоатомные спирты.
Структурная формула
Также вы можете скачать:
- Пробный вариант №1 ЕГЭ 2020 г. (аналог демонстрационного варианта ЕГЭ 2020 г.) с ответами в формате pdf
- Пробный вариант 2. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 3. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 4. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 5. ЕГЭ 2020 по химии с ответами в формате pdf
- Демонстрационный вариант ЕГЭ 2020 (с сайта ФИПИ)
- Кодификатор ЕГЭ 2020 (с сайта ФИПИ)
- Спецификация ЕГЭ 2020 (с сайта ФИПИ)
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку