Скачать Пробный вариант 4. ЕГЭ 2020 по химии с ответами в формате pdf
Вариант 4
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
1) Mg; 2) Se; 3) Al; 4) Те; 5) S.
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
- Определите, атомы каких из указанных элементов в основном состоянии имеют только 2 спаренных электрона на внешнем электронном слое. Запишите в поле ответа номера выбранных элементов.
- Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе. Расположите выбранные элементы в порядке уменьшения основных свойств, образуемых ими высших оксидов. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
- Из числа указанных в ряду элементов выберите два элемента, которые имеют постоянную степень окисления и валентность в соединениях. Запишите в поле ответа номера выбранных элементов.
- Из предложенного перечня выберите два типа химической связи, которая может присутствовать в твёрдых веществах молекулярного строения.
1) ковалентная полярная
2) ионная
3) металлическая
4) водородная
5) ковалентная неполярная
Запишите в поле ответа номера выбранных типов химической связи.
- Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА |
| А) оксид олова (II) | 1) оксиды амфотерные |
| Б) оксид азота (IV) | 2) оксиды кислотные |
| В) оксид кремния (II) | 3) оксиды несолеобразующие |
| 4) оксиды основные |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два вещества, с каждым из которых НЕ взаимодействует сера.
1) O2
2) KOH
3) NaF
4) HCl
5) Zn
Запишите в поле ответа номера выбранных веществ.
- В раствор, в котором были растворены карбонат натрия и сульфат рубидия, добавили избыток раствора сильной кислоты X. В результате образовался новый раствор, к которому добавили избыток раствора соли Y. В итоге в конечном растворе можно обнаружить ионы Ba2+, H+, Rb+, Na+, NO3—. Из предложенного перечня выберите вещества Х и Y, которые подходят под данное описание.
1) нитрат бария
2) карбонат бария
3) сернистая кислота
4) серная кислота
5) хлорид бария
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
- Установите соответствие между названием вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) хлор | 1) H2S, NaOH, C4H10 |
| Б) кислород | 2) O2, SO3, CH4 |
| В) сера | 3) C3H8, Fe, N2 |
| Г) фосфор | 4) Hg, HNO3, Cl2 |
| 5) O2, S, Cl2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между исходными веществами, вступающими в реакцию, и продуктами, которые образуются в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ ВЕЩЕСТВА | ПРОДУКТЫ РЕАКЦИИ |
| А) PCl5 + NaOH (изб.) | 1) Na3PO4, HCl, H2O |
| Б) Na2HPO4 + NaOH | 2) Na3PO4, H2O |
| В) Na2HPO4 + H3PO4 | 3) NaH2PO2,PH3 |
| Г) P4 + NaOH (p-p) | 4) NaH2PO4 |
| 5) Na3PO4, NaCl, H2O | |
| 6) H3PO4, NaCl, H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Задана следующая схема превращений веществ:
H2 →X → Y →CuS
Определите, какие из указанных веществ являются веществами X и Y.
1) H2S
2) SO2
3) H2SO4
4) K2S
5) FeS2
Запишите в таблицу номера веществ под соответствующими буквами.
- Установите соответствие между классом/группой органических соединений и формулой представителя это класса: к каждой позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
| КЛАСС/ГРУППА
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
ФОРМУЛА ПРЕДСТАВИТЕЛЯ |
| А) нитроалканы
Б) предельные карбоновые кислоты В) альдегиды |
1) CH3NO2
2) CH3CHO 3) C15H31COOH 4) C17H33COOH |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два верных утверждения, которые характеризуют строение альдегидной группы.
1) между атомами углерода и кислорода одинарная химическая связь
2) на атоме кислорода образуется избыток электронной плотности, а на атоме углерода — недостаток
3) связь С=О НЕ поляризована
4) смещение электронной плотности в связи С – Н происходит к атому водорода
5) все связи ковалентные полярные
Запишите в поле ответа номера выбранных утверждений.
- Из предложенного перечня выберите две пары веществ, при гидрировании которых в мольном соотношении 1:1 образуются гомологи.
1) бутен-1 и пентадиен-1,4
2) пропин и ацетилен
3) этен и пропан
4) ацетилен и бензол
5) бензол и толуол
Запишите в поле ответов номера выбранных пар веществ.
- Из предложенного перечня выберите два вещества, взаимодействие которых с уксусной кислотой НЕ приводит к образованию соли.
1) пропанол-1
2) кислород
3) этиламин
4) гидрокарбонат натрия
5) аммиак
Запишите в поле ответа номера выбранных веществ.
- Из предложенного перечня выберите два вещества, которые могут образоваться при взаимодействии метиламина и серной кислоты.
1) [NH3 – CH3]HOSO3
2) [NH2(OH) – CH3]SO4
3) [NH2(CH3)2]HSO4
4) [NH3 – CH3]2SO4
5) [NH3 – C2H5]2SO4
Запишите в поле ответа номера выбранных веществ.
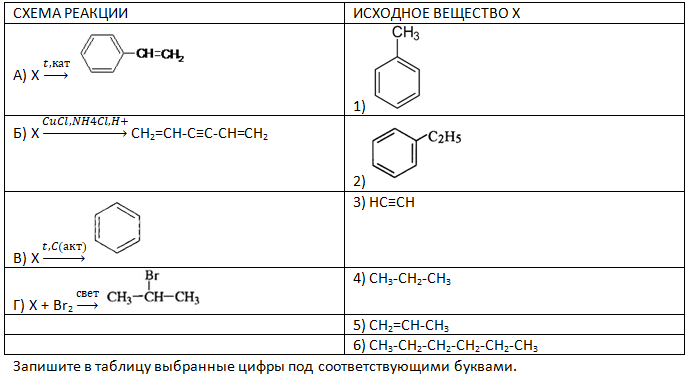
- Установите соответствие между схемой реакции и исходным веществом Х, которое вступает в эту реакцию: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ могут являтся веществами X и Y.
1) 2,2-дибром-2,4-диметилпентан
2) 2,3-дибром-2,4-диметилпентан
3) 2,4-диметилпентадиен-1,3
4) 4-бром-2,4-диметилпентен-2
5) 3-бром-2,4-диметилпентен-1
Запишите в таблицу номера веществ под соответствующими буквами.
- Из предложенного перечня выберите две схемы реакций, которые являются и реакциями соединения и окислительно-восстановительными.
1) Zn(OH)2 + NaOH → Na2[Zn(OH)4]
2) Cu(NO3)2 → CuO + NO2 + O2
3) K + H2O → KOH + H2
4) SO2 + O2 + H2O → H2SO4
5) PH3 + O2 → H3PO4
Запишите в поле ответа номера выбранных схем реакций.
- Из предложенного перечня выберите два внешних воздействия, которые оказывают наименьшее влияние на скорость химической реакции взаимодействия разбавленной серной кислоты с металлом средней активности.
1) изменение рН кислоты
2) изменение давления
3) повышение температуры
4) изменение размера гранул металла
5) добавление малоактивного металла
Запишите в поле ответа номера выбранных внешних воздействий.
- Установите соответствие между изменением степени окисления азота и схемой химического превращения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ АЗОТА | СХЕМА ПРЕВРАЩЕНИЯ |
| А) 0 → -3 | 1) NO → NO2 |
| Б) +2 → +4 | 2) N2 → NH3 |
| В) не изменяется | 3) NH3 → NH4NO3 |
| 4) N2H4→ N2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между формулой кислоты и схемой процессов протекающих на аноде при электролизе водного раствора этой кислоты (электроды инертные): к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА КИСЛОТЫ | ПРОЦЕСС НА АНОДЕ |
| А) HNO3 | 1) 2H2O – 4e— = 4H+ + O2 |
| Б) H2SO4 | 2) 2NO3— – 2e— = 2NO2 + O2 |
| В) HBr | 3) 2SO42- – 4e— = 2SO3 + O2 |
| Г) HI | 4) 2Br— – 2e— = Br2 |
| 5) 2I— – 2e— = I2 | |
| 6) 4OH— – 4e— = 2H2O + O2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названием соли и отношением этой соли к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
| А) нитрат алюминия | 1) гидролизуется по катиону |
| Б) нитрат ртути (II) | 2) гидролизуется по аниону |
| В) хлорид меди (II) | 3) гидролизу не подвергается |
| Г) сульфат цезия | 4) гидролизуется по катиону и аниону |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между фактором, действующим на равновесную систему H2 (г) + Br2 (г) ↔ 2HBr (г) + Q, и направлением смещения химического равновесия в этой системе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| УРАВНЕНИЕ РЕАКЦИИ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) введение катализатора | 1) смещается в сторону прямой реакции |
| Б) повышение концентрации HBr | 2) смещается в сторону обратной реакции |
| В) повышение температуры | 3) практически не смещается |
| Г) понижение концентрации H2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названием веществ, взятых в виде водных растворов, и рН раствора (молярные концентрации веществ одинаковые): к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | рН РАСТВОРА |
| А) фенилаланин | 1) 2,1 |
| Б) аммиак | 2) 11,2 |
| В) метиламин | 3) 7 |
| Г) муравьиная кислота | 4) 12,7 |
| 5) 15 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие смесью веществ и методом, с помощью которого эти вещества можно разделить: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СМЕСЬ | МЕТОД РАЗДЕЛЕНИЯ |
| А) поваренная соль и вода | 1) центрифугирование |
| Б) песок и вода | 2) дистилляция |
| В) спирт и вода | 3) фильтрование |
| 4) выпаривание |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Вычислите массовую долю хлороводорода (в %), которую можно получить растворением 100 л (н.у.) хлороводорода в 320 г раствора хлороводорода с массовой долей растворённого вещества 8%. (Запишите число с точностью до целых.)
- Какой объём кислорода (в литрах, н.у.) потребуется для окисления фосфора, если в результате этого выделяется 720 кДж теплоты, а реакция протекает согласно термохимическому уравнению 4P + 5O2 = 2P2O5 + 3010 кДж. (Запишите число с точностью до десятых.)
- Вычислите химическое количество водорода (в молях), образовавшегося в реакции взаимодействия 2,3 г натрия с водой. (Запишите число с точностью до сотых.)
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
серная кислота (разбавленная), гипохлорит натрия, гидроксид меди (II), фторид магния, оксид серебра (I), иодид калия. Допустимо использование водных растворов веществ.
- Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с образованием осадка в кислой среде. Выделение газа в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
- Из предложенного перечня веществ выберите два вещества, которые вступают в реакцию нейтрализации. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
- Гидроксид железа (II) растворили в необходимом количестве концентрированной азотной кислоты, при этом наблюдали растворение осадка и выделение бурого газа. К полученному раствору добавили раствор карбоната калия, в результате чего образовался осадок. Осадок отделили и добавили в соляную кислоту, которая была в стехиметрическом количестве, необходимом для реакции. Далее в полученный раствор опустили железную пластинку и нагревали до полного растворения пластинки, в результате чего цвет раствора изменился. Напишите уравнения четырёх описанных реакций.
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
- Раствор массой 150 г, содержащий нитрат натрия и нитрат железа (III), выпарили, а сухой остаток прокалили до постоянной массы. В результате получили твёрдый остаток массой 40,73 г. После обработки полученного твёрдого остатка водой, его масса уменьшилась на 62,68%. Рассчитайте суммарную массовую долю солей в исходном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических венличин).
- К смеси газообразного углеводорода с аммиаком общим объёмом 300 л прибавили избыток кислорода и смесь подожгли. После полного сгорания объём смеси стал равен 1250 л, после конденсации паров воды уменьшился до 550 л, а после обработки щёлочью уменьшился до 250 л, из которых 100 л приходится на азот. Объёмы газов измерены в одинаковых условиях.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение нитрования этого вещества по Коновалову (используйте структурные формулы органических веществ).
Система оценивания экзаменационной работы по химии
Часть 1
За правильный ответ на каждое из заданий 1–6, 11–15, 19–21, 26–29 ставится 1 балл.
Задание считается выполненным верно, если экзаменуемый дал правильный ответ в виде последовательности цифр или числа с заданной степенью точности.
Задания 7–10, 16–18, 22–25 считаются выполненными верно, если правильно указана последовательность цифр.
За полный правильный ответ заданий 7–10, 16–18, 22–25 ставится 2 балла; если допущена одна ошибка – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
| Номер задания | Правильный ответ |
| 1 | 13 |
| 2 | 425 |
| 3 | 13 |
| 4 | 15 |
| 5 | 123 |
| 6 | 34 |
| 7 | 41 |
| 8 | 1345 |
| 9 | 5243 |
| 10 | 14 |
| 11 | 132 |
| 12 | 25 |
| 13 | 25 |
| 14 | 12 |
| 15 | 14 |
| 16 | 2334 |
| 17 | 1621 |
| 18 | 23 |
| 19 | 45 |
| 20 | 25 |
| 21 | 213 |
| 22 | 1145 |
| 23 | 1113 |
| 24 | 3222 |
| 25 | 3241 |
| 26 | 432 |
| 27 | 39 |
| 28 | 26,8 |
| 29 | 0,05 |
Часть 2
Критерии оценивания заданий с развёрнутым ответом
За выполнение заданий 30, 31 ставится от 0 до 2 баллов; задания 35 – от 0 до 3 баллов; заданий 32 и 34 – от 0 до 4 баллов; задания 33 – от 0 до 5 баллов.
Задание 30
Вариант ответа:
NaClO + 2KI + H2SO4 → I2↓ + NaCl + K2SO4 + H2O
1 Cl+1 + 2ē → Cl-1
1 2I-1 – 2ē → I20
Иодид калия или иод в степени окисления -1 является восстановителем.
Гипохлорит натрия или хлор в степени окисления +1 – окислителем
Задание 31
Вариант ответа:
H2SO4 + Cu(OH)2 = CuSO4 + 2H2O
2H+ + SO42- + Cu(OH)2 = Cu2+ + SO42- + 2H2O
2H+ + Cu(OH)2 = Cu2+ + 2H2O
Задание 32
Вариант ответа:
Fe(OH)2 + 4HNO3 = Fe(NO3)3 + NO2 + H2O
3K2CO3 + 2Fe(NO3)3 + 3H2O = 2Fe(OH)3 + 6KNO3 + 3CO2
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
2FeCl3 + Fe = 3FeCl2
Задание 33
Примечание. Допустимо использование структурных формул разного вида (развёрнутой, сокращённой, скелетной), однозначно отражающих порядок связи атомов и взаимное расположение заместителей и функциональных групп в молекуле органического вещества.
Задание 34
Объяснение этой задачи вы можете найти на Ютуб по ссылке
Ответ: 51,7%
Задание 35
Запишем уравнения полного сгорания углеводорода и аммиака:
2CxHy + (2x + 0,5y)O2 = 2xCO2 + yH2O (уравнение 1)
4NH3 + 3O2 = 2N2 + 6H2O (уравнение 2)
Для вывода формулы, надо знать количество углерода, которое перешло из углеводорода в углекислый газ и количество водорода, перешедшего в воду по уравнению 1.
Вода при условиях опыта – газ. Поэтому по данным условия находим объём газообразной воды с учётом того, что вода выделяется в обоих уравнениях:
Vобщ (H2O) = 1250 л – 550 л = 700 л
Так как нам по условию задачи известен объём азота, то по уравнению 2 мы можем найти воду, которая образовалась в этом уравнении и потом найти объём газообразной воды, образовавшейся по уравнению 1.
V2 (H2O) = 3V (N2) = 3 ∙ 100 л = 300 л (по уравнению 2)
V1 (H2O) = Vобщ (H2O) – V2 (H2O) = 700 л – 300 л = 400 л
Находим химическое количество водорода в воде, образовавшейся по уравнению 1:
n1 (H2O) 400 л/22,4 л/моль = 17,86 моль
n (H) = 2n1 (H2O) = 2 ∙ 17,86 моль = 35,72 моль
Теперь найдём химическое количество углерода через углекислый газ, который поглотился щёлочью:
CO2 + NaOH = NaHCO3 или CO2 + 2NaOH = Na2CO3 + H2O
Анализируя уравнения, делаем вывод, что объём смеси уменьшился за счёт поглощённого углекислого газа, значит V (CO2) = 550 л – 250 л = 300 л
n (CO2) = 300 л/22,4 л/моль = 13,39 моль
n (C) = n (CO2) = 13,39 моль
Теперь выводим формулу углеводорода. Для этого необходимо сделать перерасчёт на 1 моль вещества. Значит, необходимо узнать, сколько углеводорода было в смеси.
V (NH3) = 2V (N2) = 200 л (по уравнению 2)
V (CxHy) = V (исходной смеси) – V (NH3) = 300 л -200 л = 100 л
n (CxHy) = 100 л/22,4 л/моль = 4,46 моль
4,46 моль углеводорода содержит 13,39 моль углерода и 35,72 моль водорода
1 моль углеводорода содержит x моль углерода и y моль водорода.
По пропорции:
x = 3
y = 8
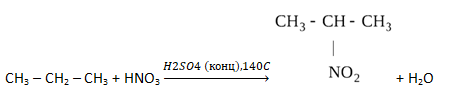
Следовательно, молекулярная формула углеводорода C3H8
Структурная формула CH3 – CH2 – CH3
Уравнение нитрования по Коновалову:
Также вы можете скачать:
- Пробный вариант №1 ЕГЭ 2020 г. (аналог демонстрационного варианта ЕГЭ 2020 г.) с ответами в формате pdf
- Пробный вариант 2. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 3. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 4. ЕГЭ 2020 по химии с ответами в формате pdf
- Демонстрационный вариант ЕГЭ 2020 (с сайта ФИПИ)
- Кодификатор ЕГЭ 2020 (с сайта ФИПИ)
- Спецификация ЕГЭ 2020 (с сайта ФИПИ)
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку


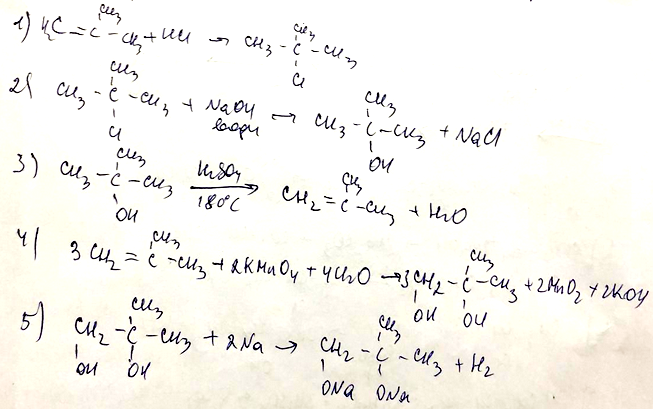
Скажите, пожалуйста, почему в 1 задании ответом является алюминий
Здравствуйте. Так как у алюминия конфигурация внешнего электронного слоя 3s2 3p1, то есть два электрона спаренных (на s-подуровне) и один неспаренный (на p-подуровне). А в задании и спрашивают найти элементы, у которых на внешнем слое только 2 спаренных электрона (про неспаренные электроны не спрашивают)