Скачать Пробный вариант 3. ЕГЭ 2021 по химии с ответами в формате pdf
Часть 1
Ответом к заданиям 1–26 является последовательность цифр. Ответ запишите в поле ответа в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Последовательность цифр записывайте без пробелов, запятых и других дополнительных символов. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. Цифры в ответах на задания 5, 8, 9, 11, 16, 17, 21–26 могут повторяться.
Для выполнения заданий 1–3 используйте следующий ряд химических элементов. Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
1) Mn 2) B 3) Si 4) N 5) Sb
- Определите элементы из указанных, атомы которых в основном состоянии содержат не более двух неспаренных электрона.
Запишите в поле ответа номера выбранных элементов.
- Из указанных в ряду химических элементов выберите три элемента-полуметалла. Расположите выбранные элементы в порядке возрастания их электроотрицательности.
|
|
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
- Из указанных в ряду элементов выберите два элемента, которые не проявляют степень окисления +5.
Запишите в поле ответа номера выбранных элементов.
- Выберите два типа химической связи, которые присутствуют в одной формульной еденице формиата натрия (при н.у.).
1) ковалентная неполярная
2) ковалентная полярная
3) ионная
4) водородная
5) металлическая
Запишите в поле ответа номера выбранных веществ.
- Установите соответствие между названием вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
| КЛАСС/ГРУППА | НАЗВАНИЕ ВЕЩЕСТВА |
| А) водородные соединения | 1) фосфин |
| Б) щёлочи | 2) гидроксид рубидия |
| В) трёхосновные кислоты | 3) ортофосфорная кислота |
| 4) гидроксид алюминия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два вещества, которые взаимодействуют как с оксидом цинка, так и с оксидом алюминия.
1) H2O
2) CuO
3) K2O
4) SnO
5) CO
Запишите в поле ответа номера выбранных веществ.
- К двум пробиркам, с избытком раствора бромоводорода, добавили вещество Х и вещество Y соответственно. В результате в первой пробирке наблюдалось растворение осадка и образование окрашенного раствора, а во второй реакции протекала согласно ионному уравнению H+ + MgOH+ → Mg2+ + H2O. Из предложенного перечня выберите вещества Х и Y, которые могут вступить в описанные реакции.
1) сульфид ртути (II)
2) гидроксид алюминия
3) гидроксид меди (II)
4) гидроксосульфат магния
5) гидроксид магния
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названием вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) литий | 1) HBr, NaOH, SrO |
| Б) сернистый газ | 2) Ca(OH)2, CuCl2, AgF |
| В) гидроксид алюминия | 3) O2, KOH, Br2 |
| Г) иодид алюминия | 4) Si, Cu(OH)2, O2 |
| 5) N2, C2H5OH, H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между реагирующими веществами и продуктами их взаимодействия: к каждой позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ |
| А) Hg2O + HNO3 (конц.) → | 1) Hg(NO3)2 + NO2 + H2O |
| Б) HgO + HNO3 (разб.) → | 2) HgNO3 + H2O |
| В) Hg + HNO3 (конц.) → | 3) HgO + KNO3 + H2O |
| Г) Hg(NO3)2 + KOH → | 4) Hg(OH)2 + KNO3 |
| 5) Hg(NO3)2 + H2O | |
| 6) Hg(NO3)2 + NO + H2O |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Задана следующая схема превращений:
 Определите, какие из указанных веществ являются веществами Х и Y.
Определите, какие из указанных веществ являются веществами Х и Y.
1) KCl
2) Cl2
3) NaClO
4) NaClO3
5) MnCl2
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названием вещества и гомологической формулой класса (группы), к которому оно относится: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ГОМОЛОГИЧЕСКАЯ ФОРМУЛА |
| А) ацетон | 1) С2H2n-6 |
| Б) 3-метилфенол | 2) CnH2nO |
| В) дивинил | 3) CnH2n-6O |
| 4) С2H2n-2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два вещества немолекулярного строения, в которых все атомы углерода находятся в состоянии sp2-гибридизации.
1) оксалат натрия
2) ацетат калия
3) стирол
4) хлорид метиламмония
5) формиат кальция
- Из предложенного перечня выберите два вещества, для которых невозможно как 1,2-, так и 1,4-присоединение.
1) изопрен
2) бутадиен-1,3
3) пентадиен-1,3
4) гексадиен-1,5
5) гексин-1
- Из предложенного перечня веществ выберите два соединения, с каждым из которых реагирует щавелевая кислота.
1) вода
2) метанол
3) метаналь
4) гидроксид калия
5) сульфат калия
- Из предложенного перечня соединений, выберите два вещества, с которыми реагирует 2-аминопропановая кислота.
1) аланин
2) циклогексан
3) толуол
4) этиленгликоль
5) хлорид калия
- Установите соответствие между формулой алкена и продуктом, который преимущественно образуется при взаимодействии этого вещества с бромоводородом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
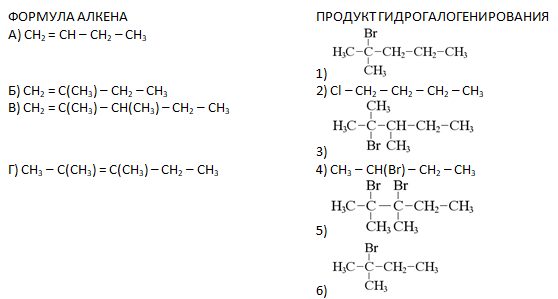 Запишите в таблицу выбранные цифры под соответствующими буквами.
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите между схемой реакции и веществом Х: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
 Запишите в таблицу выбранные цифры под соответствующими буквами.
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Задана схема превращений веществ:
![]() Определите, какие из указанных веществ являются веществами Х и Y.
Определите, какие из указанных веществ являются веществами Х и Y.
1) молочная кислота
2) 2-нитропропановая кислота
3) 2-хлорпропановая кислота
4) β-хлорпропионовая кислота
5) хлорангидрид пропановой кислоты
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня типов реакций выберите те, которые верно характеризуют взаимодействие алюминия с серой при сплавлении.
1) гетерогенная
2) соединения
3) окислительно-восстановительная
4) необратимая
5) экзотермическая
Запишите номера выбранных ответов.
- Из предложенного перечня выберите способ(-ы), с помощью которого(-ых) можно увеличить скорость реакции между этановой кислотой и этанолом.
1) добавление воды
2) добавление металлического натрия
3) нагревание
4) добавление щёлочи
5) увеличение общего давления
Запишите номер(-а) выбраного(-ных) ответа(-ов).
- Установите соответствие между схемой реакции и свойством, которое проявляет элемент марганец в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | СВОЙСТВО МАРГАНЦА |
| А) HMnO4 → MnO2 + O2 + H2O | 1) является окислителем |
| Б) NaMnO4 → Na2MnO4 + MnO2 + O2 | 2) является восстановителем |
| В) Na2MnO4 + H2O → NaMnO4 + MnO2 + NaOH | 3) является и окислителем, и восстановителем |
| 4) не изменяет степень окисления |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названиями водных растворов смешиваемых реагентов и продуктом электролиза раствора образовавшегося после реакции между исходными реагентами, который образуется на катоде: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЯ СМЕШИВАЕМЫХ ВОДНЫХ РАСТВОРОВ РЕАГЕНТОВ | ПРОДУКТ НА КАТОДЕ |
| 1) р-р нитрата серебра (I) + р-р гидроксида натрия + р-р аммиака | 1) H2 |
| 2) р-р перманганата бария + р-р серной кислоты | 2) O2 |
| 3) р-р гидроксида бария + р-р сульфата натрия | 3) Na |
| 4) р-р хлорида меди (II) + р-р нитрата серебра (I) | 4) Cu |
| 5) Ag | |
| 6) Ba |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между формулой соли и средой водного раствора этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
| А) ZnCl2 | 1) кислая |
| Б) Al(NO3)3 | 2) щелочная |
| В) KMnO4 | 3) нейтральная |
| Г) KHSO4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между способом воздействия на равновесную систему, которая протекает согласно уравнению
CH4 (г) ↔ C (тв) + 2H2 (г) – Q,
и направлением смещения равновесия при этом воздействии: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СПОСОБ ВОЗДЕЙСТВИЯ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) внесение катализатора | 1) смещается вправо |
| Б) понижение температуры | 2) смещается влево |
| В) увеличение давления | 3) практически не смещается |
| Г) выведение водорода из реакционной смеси |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между формулой вещества, которое внесено в бесцветное пламя спиртовки, и окраской, которую приобретает пламя: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ОКРАСКА ПЛАМЕНИ |
| А) Ba(NO3)2 | 1) голубая |
| Б) CaCl2 | 2) жёлто-зелёная |
| В) KOH | 3) жёлтая |
| Г) NaHCO3 | 4) кирпично-красная |
| 5) фиолетовая |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между химической посудой и способом её применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ХИМИЧЕСКАЯ ПОСУДА | ПРИМЕНЕНИЕ |
| А) шпатель | 1) набор порции твёрдых сыпучих веществ |
| Б) пипетка | 2) хранение жидких веществ |
| В) бюретка | 3) добавление точного объёма жидкости по каплям |
| 4) набор порции жидкости |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответом к заданиям 27–29 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Затем перенесите это число в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. Единицы измерения физических величин в бланке ответа указывать не нужно.
При проведении расчётов для всех элементов кроме хлора используйте значения относительных атомных масс, выраженных целыми числами (Ar(Cl) =35,5).
- Сколько граммов 98%-ного раствора этанола надо добавить к 234 г воды, чтобы получить 10%-ный раствор? (Запишите число с точность до сотых.)
- В результате реакции ионного обмена, термохимическое уравнение которой
H+ + OH— = H2O + 57 кДж,
выделилось 8,55 кДж теплоты. Вычислите массу гидроксида натрия, затраченного на эту реакцию. (Запишите число с точностью до целых.)
- Рассчитайте объём газа (в литрах), образовавшегося в результате полного сгорания пирита массой 60 г в избытке кислорода. (Запишите число с точностью до десятых.)
Часть 2
Для записи ответов на задания 30–35 используйте БЛАНК ОТВЕТОВ № 2. Запишите сначала номер задания (30, 31 и т.д.), а затем его подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 30, 31 используйте следующий перечень веществ: иодид калия, гидроксонитрат меди (II), концентрированная серная кислота, серебро, хлорид натрия, гидроксид стронция. Допустимо использование водных растворов веществ.
- Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми одними из продуктов являются кислая соль и три вещества молекулярного строения. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
- Из предложенного перечня выберите два вещества, при протекании реакции ионного обмена между которыми образуется окрашенный осадок, а выделения газа не происходит. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
- К раствору хлорида хрома (III) добавили избыток раствора едкого кали. К образовавшемуся раствору добавили бром. После завершения реакции к раствору прилили раствор серной кислоты. Образовавшуюся при этом соль хрома выделили, растворили в воде и полученный раствор прилили к раствору хлорида бария, в результате чего образовался жёлтый осадок. Напишите уравнения четырёх описанных реакций.
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
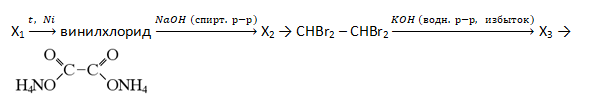 При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.
При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.
- 141,5 г смеси фосфата калия и оксида фосфора (V), в которой массовая доля фосфора как элемента составляет 21,91%, растворили в 400 г воды. Определите массовые доли веществ в полученном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
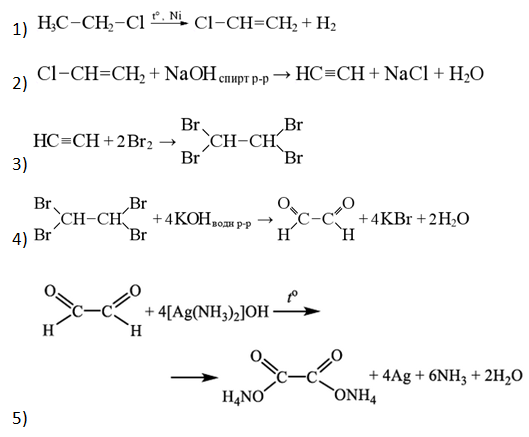
- При сгорании 13,28 г органического вещества А получили 3,8528∙1023 молекул углекислого газа и 4,32 мл воды.
Известно, что вещество А содержит атомы углерода только в sp2-гибридизации, заместители максимально удалены друг от друга, а также может вступать в реакцию с метанолом (в присутствии серной кислоты) в соотношении либо 1:1 либо 1:2.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества А;
2) составьте структурную формулу вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции взаимодействия вещества А с метанолом (в присутствии серной кислоты) в соотношении 1:2 соответственно (используйте структурные формулы органических веществ).
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
Ответы:
Первая часть:
- 23
- 532
- 23
- 23
- 123
- 35
- 34
- 5312
- 1513
- 24
- 234
- 15
- 45
- 24
- 14
- 4633
- 4225
- 31
- 12345
- 3
- 113
- 5114
- 1131
- 3221
- 2453
- 143
- 26,59
- 6
- 22,4
Вторая часть:
- 8KI + 9H2SO4 = 8KHSO4 + 4I2↓ + H2S↑ + 4H2O (допустимо образование K2SO4)
2I-1 – 2e = I20 4
S+6 + 8e = S-2 1
Сера в степени окисления +6 (или H2SO4) является окислителем.
Иод в степени окисления -1 (или KI) является восстановителем.
- 2CuOHNO3 + Sr(OH)2 = 2Cu(OH)2↓ + Sr(NO3)2
2CuOH+ + 2NO3— + Sr2+ + 2OH— = 2Cu(OH)2↓ + Sr2+ + 2NO3—
CuOH+ + OH— = Cu(OH)2↓
- 1) CrCl3 + 6KOH = K3[Cr(OH)6] + 3KCl
2) 2K3[Cr(OH)6] + 3Br2 + 4KOH = 2K2CrO4 + 6KBr + 8H2O
3) 2K2CrO4 + 2H2SO4 = K2Cr2O7 + 2KHSO4 + H2O (допустимо образование K2SO4)
4) K2Cr2O7 + 2BaCl2 + H2O = 2BaCrO4↓ + 2KCl + 2HCl
Видео-объяснение смотрите на Ютуб по ссылке или ниже
- 1) исходное органическое вещество точно содержит в своём составе атомы элементов углерод и водород, так как при сгорании этого вещества образуются углекислый газ и вода. А кислород как может входить в состав это вещества, так может и не входить. Проверить это можно сложив массы атомов элементов углерода и водорода, если эта сумма будет равна массе исходного органического вещества, то кислорода нет, а если масса окажется меньше – то кислород есть, и разница между массой вещества за вычетом масс атомов элементов углерода и водорода и есть масса атомов элемента кислорода.
Найдём эти массы:
n = N/NA, n = m/M
m = n ∙ M,
n (CO2) = 3,8528 молекул / 6,02∙1023 моль-1 = 0,64 моль
n (С) = n (СО2) = 0,64 моль
m (C) = 0,64 моль ∙ 12 г/моль = 7,68 г
т.к. плотность воды 1 г/мл, то m (H2O) = 4,32 мл ∙ 1 г/мл = 4,32 г
М(Н2О) = 18 г/моль
n (H2O) = 4,32 г / 18 г/моль = 0,24 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 0,24 моль = 0,48 моль
m (H) = 0,48 моль ∙ 1 г/моль = 0,48 г
m (C) + m (H) = 7,68 г + 0,48 г = 8,16 г, что НЕ равно массе исходного вещества, а значит атомы кислорода присутствуют в веществе.
m (O) = 13,28 г – 8,16 г = 5,12 г
n (O) = 5,12 г / 16 г/моль = 0,32 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 0,64 : 0,48 : 0,32 = 2 : 1,5 : 1 = 4 : 3 : 2. Но составить структурную формулу с таким соотношением атомов не представляется возможным, поэтому данные индексы надо ещё раз удвоить.
Следовательно молекулярная формула вещества: C8H6O4.
2) Анализируя информацию о веществе А, можно предположить, что данное вещество является ароматическим, так как молекула содержит небольшое число атомов водорода. И так как реагирует со спиртами, то это может быть карбоновая кислота, но с учётом разного соотношения – дикарбоновая кислота, причем вторая карбоксильная группа находится в пара-полложении, так как сказано, что заместители максимально удалены друг от друга.
Следовательно, структурная формула — 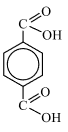 3) Уравнение реакции взаимодействия вещества А с метанолом (в присутствии серной кислоты) в соотношении 1:2 соответственно:
3) Уравнение реакции взаимодействия вещества А с метанолом (в присутствии серной кислоты) в соотношении 1:2 соответственно:
В случае, если вы нашли ошибку или опечатку, просьба сообщать об этом автору проекта в контакте https://vk.com/id30891697 или на электронную почту yoursystemeducation@gmail.com
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет (реальные, пробные и тренировочные задания) вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку