Скачать Пробный вариант 10. ЕГЭ 2020 по химии с ответами в формате pdf
Вариант 10
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
1) H; 2) O; 3) B; 4) Zn; 5) N.
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду
- Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют вакантные орбитали. Запишите в поле ответа номера выбранных элементов.
- Из указанных в ряду химических элементов выберите три элемента, которые образуют простые вещества молекулярного строения. Расположите выбранные элементы в порядке возрастания их неметаллических свойств. Запишите в поле ответа номера выбранных элементов в нужной последовательности.
- Из числа указанных в ряду элементов выберите два элемента, которые способны в соединениях проявлять валентность III только за счёт образования ковалентных связей по обменному механизму. Запишите в поле ответа номера выбранных элементов.
- Из предложенного перечня характеристик выберите две, которые могут быть справедливы для веществ с металлической кристаллической решёткой.
1) низкая электропроводность
2) высокая электропроводность
3) ковкость и пластичность
4) ионный тип связи между атомами
5) газообразное агрегатное состояние при н.у.
Запишите в поле ответа номера выбранных характеристик.
- Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА |
| А) Pb(OH)2 | 1) кислоты |
| Б) H2SeO4 | 2) гидроксиды амфотерные |
| В) N2O | 3) оксиды несолеобразующие |
| 4) основания |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует железо с образованием продукта, в котором железо проявляет степень окисления +2.
1) S
2) H2SO4 конц.
3) Cl2
4) HCl
5) O2 изб.
Запишите в поле ответа номера выбранных веществ.
- В пробирку с избытком гидроксида меди (II) добавили несколько капель соляной кислоты. В результате чего над осадком появился раствор соли, который отделили от осадка и разлили в две пробирки. В одну из пробирок добавили раствор вещества Х, а в другую – раствор вещества Y. В результате в первой пробирке наблюдали образование осадка, а во второй пробирке протекала реакция, которую можно описать сокращённым ионным уравнением: CuOH+ + H+ = Cu2+ + H2O. Из предложенного перечня выберите вещества Х и Y, которые могут вступать в описанные реакции.
1) NaOH
2) HCl
3) NaCl
4) Al2O3
5) H2O
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
- Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) Be | 1) HBr, SO2, NaHSO3 |
| Б) Be(OH)2 | 2) O2, Cl2, Ba |
| В) NaOH | 3) HNO3, Cu, H3PO4 |
| Г) CuCl2 | 4) HCl, H2SO4, KOH (p-p) |
| 5) CsOH (p-p), (NH4)2S (p-p), AgNO3 (p-p) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между исходным(и) веществом(-ами), вступающим(и) в реакцию, и продуктами, которые образуются в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ИСХОДНЫЕ(-ОЕ) ВЕЩЕСТВА(-О) | ПРОДУКТЫ РЕАКЦИИ |
| А) MgO и HNO3 (разб.) | 1) Mg(NO3)2 и H2O |
| Б) Mg и HNO3 (разб.) | 2) MgO, NO2 и O2 |
| В) Mg(NO3)2 и NH3 (p-p) | 3) Mg(NO2)2 и O2 |
| Г) Mg(NO3)2 прокаливание |
4) Mg(NO3)2, NH4NO3 и H2O |
| 5) Mg(NO3)2 и H2 | |
| 6) Mg(OH)2 и NH4NO3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) NaH
2) Na2O2
3) H2
4) HBr (р-р, изб.)
5) CO2 (p-p)
Запишите в таблицу номера веществ под соответствующими буквами.
- Установите соответствие между названием вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | КЛАСС/ГРУППА
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
| А) бензол
Б) толуол В) стирол |
1) кетоны
2) спирты 3) аминокислоты 4) углеводороды |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите две пары веществ, которые являются изомерами.
1) метилпропан и метилпропен
2) бутен-1 и пентен-1
3) метан и этан
4) метилпропан и бутан
5) пропен и циклопропан
Запишите в поле ответа номера выбранных пар веществ.
- Из предложенного перечня выберите два вещества, каждое из которых может полимеризоваться.
1) стирол
2) 2-хлорбутадиен-1,3
3) 2-бромпропан
4) толуол
5) циклогексан
Запишите в поле ответов номера выбранных веществ.
- Из предложенного перечня выберите два вещества, с которыми реагирует циклопентанол.
1) K2Cr2O7
2) HBr
3) Cu(OH)2
4) NaOH
5) K2SO4
Запишите в поле ответа номера выбранных веществ.
- Из предложенного перечня выберите два вещества, с помощью которых НЕЛЬЗЯ различить водные растворы сахарозы и глюкозы.
1) гидроксид натрия
2) гидроксид меди (II)
3) аммиачный раствор оксида серебра (I)
4) бромная вода
5) хлорид натрия
Запишите в поле ответа номера выбранных веществ.
- Установите соответствие между названием вещества и продуктом, который преимущественно образуется при взаимодействии этого вещества с хлороводородом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ПРОДУКТ |
| А) пентен-1 | 1) 1-хлорпентан |
| Б) пентин-1 | 2) 2-хлорпентан |
| В) пентен-2 | 3) 1,1-дихлорпентан |
| Г) пентин-2 | 4) 2,2-дихлорпентан |
| 5) 3-хлорпентен-1 | |
| 6) 3,3-дихлорпентен-1 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между схемой реакции и органическим продуктом, который образуется в результате этого взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
1) C6H5ONa
2) C6H5NH2
3) C6H5COONa
4) C6H5NH3Cl
5) C6H5COONH4
Запишите в таблицу номера веществ под соответствующими буквами.
- Из предложенного перечня типов реакций выберите два типа реакций, к которым можно отнести взаимодействие припилена с бромом при обычных условиях.
1) присоединение
2) замещение
3) гидрогенизация
4) изомеризация
5) необратимая
Запишите в поле ответа номера выбранных типов реакций.
- Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению скорости реакции 2AgNO3(тв) = 2Ag(тв) + O2(г) + 2NO2(г).
1) понижение давления в системе
2) повышение давления в системе
3) понижение температуры
4) повышение температуры
5) размельчение AgNO3
Запишите в поле ответа номера выбранных внешних воздействий.
- Установите соответствие между формулой вещества и окислительно-восстановительными свойствами атомов серы, которые она способна проявлять: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА |
| А) H2S | 1) является только восстановителем |
| Б) H2SO4 | 2) является и окислителем, и восстановителем |
| В) Na2S2O3 | 3) не проявляет окислительно-восстановительных свойств |
| 4) является только окислителем |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названием соли и одним из продуктов электролиза водного раствора этой соли (электроды инертные): к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕМ СОЛИ | ПРОДУКТ |
| А) сульфат меди (II) | 1) гидроксид калия |
| Б) нитрат серебра (I) | 2) гидроксид натрия |
| В) хлорид калия | 3) азотная кислота |
| Г) хлорид натрия | 4) серная кислота |
| 5) соляная кислота | |
| 6) гидроксид меди (II) |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между формулой соли и средой водного раствора этой соли: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | СРЕДА РАСТВОРА |
| А) Na3PO4 | 1) щелочная |
| Б) (C2H5COO)2Sr | 2) кислая |
| В) Rb2CO3 | 3) нейтральная |
| Г) NH4Cl |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между способом воздействия на равновесную систему
алкан ↔ алкен + водород,
и направлением смещения химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) введение катализатора | 1) смещается в сторону прямой реакции |
| Б) повышение концентрации водорода | 2) смещается в сторону обратной реакции |
| В) понижение давления | 3) практически не смещается |
| Г) повышение давления |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между реагирующими веществами, и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРИЗНАК РЕАКЦИИ |
| А) гидрокарбонат натрия (р-р) и азотная кислота (разб.) | 1) растворение осадка |
| Б) гидроксид цинка и гидроксид калия (р-р) | 2) видимых изменений не наблюдается |
| В) уксусная кислота и цинка | 3) образование осадка |
| Г) бутаналь и гидроксид меди (II), t | 4) выделение газа |
| 5) обесцвечивание раствора |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между веществом и основной областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ОБЛАСТЬ ПРИМЕНЕНИЯ |
| А) алебастр | 1) в пищевой промышленности |
| Б) карборунд | 2) в органическом синтезе |
| В) угарный газ | 3) вяжущий строительный материал |
| 4) абразивный материал |
Запишите в таблицу выбранные цифры под соответствующими буквами.
27. Рассчитайте массу воды (г), которую необходимо добавить к раствору гидроксида калия массой 200 г с массовой долей растворённого вещества 12% для приготовления раствора с массовой долей гидроксида калия 5%. (Запишите число с точностью до целых.)
28. Учитывая термохимическое уравнение реакции 2H2S(г) + 3O2(г) = 2SO2(г) + 2Н2О(г) + 857,3 кДж, вычислите, сколько теплоты (кДж) выделится при сжигании сероводорода массой 17 г. (Запишите число с точностью до целых.)
- Вычислите массу сероводорода (в граммах), который может прореагировать с 3,36 л (н.у.) сернистого газа. (Запишите число с точностью до десятых.)
Для выполнения заданий 30, 31 используйте следующий перечень веществ:
хлор, оксид цинка, гидроксид натрия, хлорид железа (II), оксид железа (II), хлороводород. Допустимо использование водных растворов веществ.
- Из предложенного перечня веществ выберите вещества, между которыми окислительно-восстановительная реакция протекает с изменением цвета раствора и образованием осадка. Выделение газа в ходе этой реакции не наблюдается. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
- Из предложенного перечня веществ выберите амфотерный оксид, который в данном случае будет проявлять кислотные свойства, и вещество, которое вступает с этим оксидом в реакцию ионного обмена с образованием бесцветного раствора. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
- Силицид кальция обработали раствором бромоводородной кислоты и выделяющийся газ сожгли. Твердый продукт реакции смешали с кальцинированной содой, смесь нагрели до плавления и выдержали температуру некоторое время. После охлаждения проукт реакции растворили в воде и обработали раствором соляной кислоты, в результате чего образовался студенистый осадок. Напишите уравнения четырёх описанных реакций.
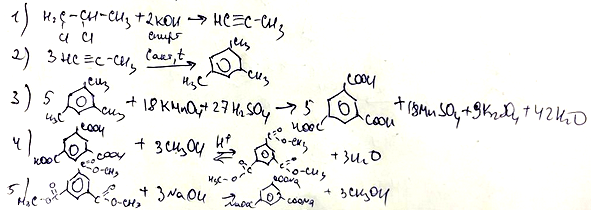
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
- Смесь кальция и алюминия общей массой 18,8 г прокалили без доступа воздуха со стехиметрическим количеством порошка графита. К образовавшимся продуктам реакции прилили воду объёмом 200 мл, при этом выделилось 11,2 л газа. Определите массовую долю гидроксида кальция в конечном растворе, если его растворимость при данных условиях составляет 0,185 г на 100 г воды. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических венличин).
- Органическое ещество А при нагревании реагирует с двухатомным спиртом Б с образованием воды и органического вещества С, которое является гетероциклическим и содержит радикал этил. В состав вещества А входит 62,07% углерода, 10,34% водорода и 27,59% кислорода, функциональная группа находится у первого атома углерода. А при сжигании двухатомного спирта Б массой 62 г образуется 54 г воды и 88 г углекислого газа.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества С;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение получения вещества С из веществ А и Б (используйте структурные формулы органических веществ).
Система оценивания экзаменационной работы по химии
Часть 1
За правильный ответ на каждое из заданий 1–6, 11–15, 19–21, 26–29 ставится 1 балл.
Задание считается выполненным верно, если экзаменуемый дал правильный ответ в виде последовательности цифр или числа с заданной степенью точности.
Задания 7–10, 16–18, 22–25 считаются выполненными верно, если правильно указана последовательность цифр.
За полный правильный ответ заданий 7–10, 16–18, 22–25 ставится 2 балла; если допущена одна ошибка – 1 балл; за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
| Номер задания | Правильный ответ |
| 1 | 34 |
| 2 | 152 |
| 3 | 35 |
| 4 | 23 |
| 5 | 213 |
| 6 | 14 |
| 7 | 12 |
| 8 | 4415 |
| 9 | 1462 |
| 10 | 25 |
| 11 | 444 |
| 12 | 45 |
| 13 | 12 |
| 14 | 12 |
| 15 | 15 |
| 16 | 2424 |
| 17 | 6144 |
| 18 | 42 |
| 19 | 15 |
| 20 | 45 |
| 21 | 142 |
| 22 | 4312 |
| 23 | 1112 |
| 24 | 3212 |
| 25 | 4143 |
| 26 | 342 |
| 27 | 280 |
| 28 | 214 |
| 29 | 10,2 |
Часть 2
Критерии оценивания заданий с развёрнутым ответом
За выполнение заданий 30, 31 ставится от 0 до 2 баллов; задания 35 – от 0 до 3 баллов; заданий 32 и 34 – от 0 до 4 баллов; задания 33 – от 0 до 5 баллов.
Задание 30
Вариант ответа:
2FeCl2 + Cl2 + 6NaOH → 2Fe(OH)3↓ + 6NaCl
1 Cl20 + 2ē → 2Cl-1
2 Fe+2 – ē → Fe+3
Хлорид железа (II) или железо в степени окисления +2 является восстановителем.
Хлор – окислителем
Задание 31
Вариант ответа:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
ZnO + 2Na+ + 2OH— + H2O = 2Na+ + [Zn(OH)4]2-
ZnO + 2OH— + H2O = [Zn(OH)4]2-
Задание 32
Вариант ответа:
Ca2Si + 4HBr = 2CaBr2 + SiH4
SiH4 + 2O2 = SiO2 + 2H2O
SiO2 + Na2CO3 = Na2SiO3 + CO2
Na2SiO3 + 2HCl = 2NaCl + H2SiO3
Задание 33
Примечание. Допустимо использование структурных формул разного вида (развёрнутой, сокращённой, скелетной), однозначно отражающих порядок связи атомов и взаимное расположение заместителей и функциональных групп в молекуле органического вещества.
Задание 34
Объяснение этой задачи вы можете найти на Ютуб по ссылке
Ответ: 0,18%
Задание 35
Найдём формулу вещества А.
Примем массу соединения А за 100 грамм, тогда количество вещества элементов следующее:
n (С) = 62,07 г/12 г/моль = 5,173 моль
n (H) = 10,34 г/1 г/моль = 10,34 моль
n (O) = 27,59 г/16 г/моль = 1,724 моль
Соотношение углерода к водороду, кислороду и азоту 5,173 : 10,34 : 1,724 = 3 : 6 : 1
Молекулярная формула вещества А C3H6O – это пропаналь.
Найдём формулу вещества Б.
n (CO2) = 88 г/44 г/моль = 2 моль
n (С) = n (СО2) = 2 моль
m (C) = 2 моль ∙ 12 г/моль = 24 г
n (H2O) = 54 г / 18 г/моль = 3 моль
n (H) = 2 ∙ n (H2O) = 2 ∙ 3 моль = 6 моль
m (H) = 6 моль ∙ 1 г/моль = 6 г
m (O) = 62 г – 24 г – 6 г = 32 г
n (O) = 32 г / 16 г/моль = 2 моль
Для нахождения молекулярной формулы необходимо найти соотношение химических количеств атомов элементов входящих в состав исходного органического вещества.
n (C) : n (H) : n (O) = 2 : 6 : 2
Следовательно молекулярная формула вещества Б: C2H6O2 – это этиленгликоль.
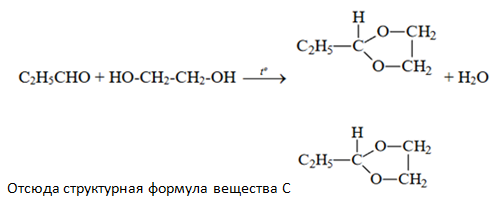
Чтобы вывести структурную формулу вещества С, лучше сначало написать уравнение взаимодействия пропаналя с этиленгликолем, с учётом образования воды и того, что вещество С является гетероциклическим (т.е. в состав цикла входят НЕ только атомы углерода) и содержит радикал этил:
Также вы можете скачать:
- Пробный вариант №1 ЕГЭ 2020 г. (аналог демонстрационного варианта ЕГЭ 2020 г.) с ответами в формате pdf
- Пробный вариант 2. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 3. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 4. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 5. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 6. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 7. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 8. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 9. ЕГЭ 2020 по химии с ответами в формате pdf
- Пробный вариант 10. ЕГЭ 2020 по химии с ответами в формате pdf
- Демонстрационный вариант ЕГЭ 2020 (с сайта ФИПИ)
- Кодификатор ЕГЭ 2020 (с сайта ФИПИ)
- Спецификация ЕГЭ 2020 (с сайта ФИПИ)
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку


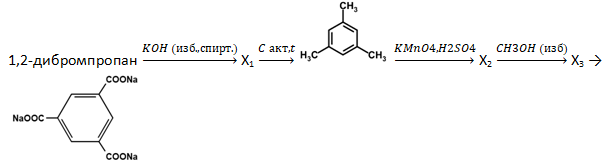
№1 из пробного варианта 10. Поясните, пожалуйста, выбор ответов 3 и 4.
Используйте следующий ряд химических элементов:
1) H; 2) O; 3) B; 4) Zn; 5) S.
Определите, атомы каких из указанных в ряду элементов в основном состоянии имеют вакантные орбитали.
Почему ответ 34?
Вакантные, т.е. свободные? Или другой подход?
У 3) В свободны две р-орбитали на 2-ом уровне.
У 4) Zn свободны р- и d — орбитали на 4-ом уровне.
А у 5) S свободны d — орбитали на 3-ом уровне.
Здравствуйте. Вы правы, здесь подходило 3 ответа. Ошибку исправил — серу заменил на азот. Спасибо за внимательность!