Скачать Пробный вариант 1. ЕГЭ 2021 по химии с ответами в формате pdf
Вариант 1
Часть 1
Ответом к заданиям 1–26 является последовательность цифр. Ответ запишите в поле ответа в тексте работы, а затем перенесите в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Последовательность цифр записывайте без пробелов, запятых и других дополнительных символов. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. Цифры в ответах на задания 5, 8, 9, 11, 16, 17, 21–26 могут повторяться.
Для выполнения заданий 1–3 используйте следующий ряд химических элементов. Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду:
1) P 2) Cl 3) Zn 4) Be 5) Al
- Среди перечисленных элементов выберите два элемента, у которых на внешнем энергетическом уровне имеется два электрона.
Запишите в поле ответа номера выбранных элементов.
- Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке усиления окислительных свойств образуемых ими простых веществ.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
- Из числа указанных в ряду элементов выберите два элемента, для которых низшее значение степени окисления меньше 0.
Запишите в поле ответа номера выбранных элементов.
- Из предложенного перечня выберите два вещества, которые имеют молекулярную кристаллическую решётку.
1) C7H8
2) CsBr
3) C6H5ONa
4) Br2
5) Ag
Запишите в поле ответа номера выбранных веществ.
- Усоответствие между классом/группой неорганических веществ и формулой вещества, принадлежащего к этому классу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
| КЛАСС/ГРУППА | ФОРМУЛА ВЕЩЕСТВА |
| А) оксид кислотный | 1) SrO |
| Б) оксид основный | 2) SeO2 |
| В) оксид амфотерный | 3) SiO |
| 4) MnO2 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два вещества, с которыми может реагировать оксид углерода (IV) в присутствии воды.
1) оксид серы (IV)
2) карбонат натрия
3) серная кислота
4) силикат калия
5) фосфат кальция
Запишите в поле ответа номера выбранных веществ.
- К одной из пробирок с раствором сульфита аммония добавили раствор вещества X, а к другой – раствор вещества Y. В результате в первой пробирке наблюдалось только выпадение белого осадка, а во второй – выделение газа с резким специфическим запахом, окрашивающим влажную лакмусовую бумажку в синий цвет. Из предложенного перечня выберите вещества Х и Y, которые могут вступить в описанные реакции.
1) Al(NO3)3
2) HCl
3) CaCl2
4) KOH
5) CuBr2
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
| А) NH4Cl | 1) P2O5, HBr, BaBr2 |
| Б) K2CO3 | 2) KMnO4, HI, H2O2 |
| В) Fe(OH)2 | 3) K2Cr2O7, Zn, H2O |
| Г) Al | 4) AgF, F2, CsOH |
| 5) N2O, O2, NaCl |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между реагирующими веществами и продуктами их взаимодействия: к каждой позиции, обозначенной буквой, подберите позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ |
| А) магний и углекислый газ | 1) карбонат магния |
| Б) оксид магния и углекислый газ | 2) оксид магния и углерод |
| В) карбонат магния и углекислый газ (р-р) | 3) гидроксид магния и силан |
| Г) силицид магния и вода | 4) гидроксид магния и кремний |
| 5) гидрокарбонат магния | |
| 6) гидроксид магния и углерод |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Задана следующая схема превращений:
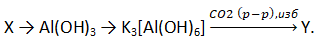 Определите, какие из указанных веществ являются веществами Х и Y.
Определите, какие из указанных веществ являются веществами Х и Y.
1) Al(OH)3
2) AlPO4
3) AlCl3
4) Al2O3∙2SiO2∙2H2O
5) Al2O3
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между формулой вещества и классом/группой, к которому (-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА ВЕЩЕСТВА | КЛАСС/ГРУППА |
| А) C20H34 | 1) карболовая кислота |
| Б) C11H22 | 2) циклоалкан |
| В) C4H8O2 | 3) арен |
| 4) сложный эфир |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Из предложенного перечня выберите два вещества, у которых есть структурные изомеры.
- Из предложенного перечня выберите два вещества, из которых в одну стадию может быть получен бутадиен-1,3:
1) изопрен
2) 2-метилпропан
3) бутанол-2
4) этиловый спирт
5) бутен-1
- Из предложенного перечня выберите два вещества, которые НЕ могут использоваться для получения пропаналя в одну стадию:
1) пропанол-1
2) пропеналь
3) 1,1-дихлорпропан
4) пропин
5) ацетат кальция
- Из предложенного перечня выберите два типа реакции, которые характерны как для глюкозы, так и для сахарозы.
1) этерификация
2) горение
3) омыление
4) гидролиз
5) гидрирование
- Установите соответствие между схемой реакции и исходным веществом Х: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ВЕЩЕСТВО Х |
| А) Х + Na → октан | 1) 2,3-дихлорбутан |
| Б) Х + Zn → метилциклобутан | 2) 1-хлорбутан |
| В) Х + Mg → бутен-2 | 3) 1,4-дихлорпентан |
| Г) Х + Mg → циклобутан | 4) 1,5-дихлорпентан |
| 5) 1,4-дихлорбутан | |
| 6) 1,2-дихлорбутан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между схемой реакции и продуктом, который образуется в результате этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | ПРОДУКТ РЕАКЦИИ |
| А) пропаналь + гидроксид меди (II) → | 1) CO2 |
| Б) формальдегид + гидроксид меди (II) → | 2) C2H5COOH |
| В) пропаналь + водород → | 3) C2H5CHO |
| Г) муравьиный альдегид + водород → | 4) C2H5CH2OH |
| 5) HCHO | |
| 6) CH3OH | |
| 7) CH3CH(OH)CH3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Задана схема превращений веществ:
Определите, какие из указанных веществ являются веществами Х и Y.
1) O2
2) CH3COOC2H5
3) Ba(OH)2
4) Ba3(PO4)2
5) BaSO4
- Из предложенного перечня выберите типы реакции, которые характеризуют взаимодействие, описанное схемой:
1) присоединения
2) замещения
3) обратимая
4) каталитическая
5) окислительно-восстановительная
Запишите номера выбранных ответов.
- Из предложенного перечня выберите все вещества, добавление которых НЕ приведёт к увеличению скорости реакции и НЕ изменит состав продуктов, если уравнение этой реакции
3C3H6 + 2KMnO4 + 4H2O → 3C3H6(OH)2 + 2MnO2 + 2KOH
1) этиленгликоль
2) перманганат калия
3) пропен
4) гидроксид натрия
5) серная кислота
Запишите номера выбранных ответов.
- Установите соответствие между схемой реакции и свойством, которое проявляет элемент хром в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА РЕАКЦИИ | СВОЙСТВО ХРОМА |
| А) CrBr2 + O2 + HBr → CrBr3 + H2O | 1) является окислителем |
| Б) Na2Cr2O7 + NaOH → Na2CrO4 + H2O | 2) является восстановителем |
| В) Na2Cr2O7 + Mg + H2SO4 → Na2SO4 + Cr2(SO4)3 + MgSO4 + H2O | 3) является и окислителем, и восстановителем |
| 4) не изменяет степень окисления |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между названием вещества и продуктом (-ами) электролиза водного раствора этого вещества, образовавшим(и)ся на инертном аноде: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА | ПРОДУКТ(Ы) НА АНОДЕ |
| 1) хлорид железа (III) | 1) водород |
| 2) гидрокарбонат калия | 2) кислород |
| 3) хлорная кислота | 3) хлор |
| 4) ацетат натрия | 4) хлороводород |
| 5) углекислый газ | |
| 6) углекислый газ и этан |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между формулой соли и характером среды её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЛИ | ХАРАКТЕР СРЕДЫ |
| А) AlBr3 | 1) кислая |
| Б) Ba(NO3)2 | 2) щелочная |
| В) KHS | 3) нейтральная |
| Г) NH4ClO4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между способом воздействия на равновесную систему
HCl (г) + H2O (ж) ↔ H+ (р-р) + Cl— (р-р) + Q
и смещением химического равновесия в результате этого воздействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВОЗДЕЙСТВИЕ НА СИСТЕМУ | НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ |
| А) добавление твёрдого гидроксида калия | 1) смещается вправо |
| Б) добавление твёрдого хлорида натрия | 2) смещается влево |
| В) понижение температуры | 3) практически не смещается |
| Г) добавление соляной кислоты |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить водные растворы этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛЫ ВЕЩЕСТВ | РЕАГЕНТ |
| А) AlBr3 и KBr | 1) KOH |
| Б) BaBr2 и KBr | 2) H2SO4 |
| В) K2SO4 и K2SO3 | 3) BaCl2 |
| Г) CuBr2 и CuSO4 | 4) Zn(OH)2 |
| 5) NaNO3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
- Установите соответствие между веществом и областью его применения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ВЕЩЕСТВО | ОБЛАСТЬ ПРИМЕНЕНИЯ |
| А) кокс | 1) добавка в некоторые газированные напитки |
| Б) фосфорная кислота | 2) в качестве катализатора для процессов гидрирования |
| В) никель | 3) получение высокомолекулярных соединений |
| 4) выплавка чугуна |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответом к заданиям 27–29 является число. Запишите это число в поле ответа в тексте работы, соблюдая при этом указанную степень точности. Затем перенесите это число в БЛАНК ОТВЕТОВ № 1 справа от номера соответствующего задания, начиная с первой клеточки. Каждый символ пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами. Единицы измерения физических величин в бланке ответа указывать не нужно.
При проведении расчётов для всех элементов кроме хлора используйте значения относительных атомных масс, выраженных целыми числами (Ar(Cl) =35,5).
- Имеется раствор сахарозы массой 125 г с массовой долей растворённого вещества 20%. Рассчитайте массовую долю сахарозы в растворе, который можно получить при добавлении 10 г сахарозы к исходному раствору (гидролиз сахарозы не учитывать). (Запишите число с точность до целых.)
Ответ: ___________ % .
- Какой объём (н.у.) водорода (в литрах) образуется при полном дегидрировании 20 л этана? (Запишите число с точностью до целых.)
Ответ: ___________ л .
- Вычислите объём кислорода в литрах (н.у.), выделившегося при разложении 189,6 г перманганата калия. (Запишите число с точностью до сотых.)
Ответ: ___________ л .
Часть 2
Для записи ответов на задания 30–35 используйте БЛАНК ОТВЕТОВ № 2. Запишите сначала номер задания (30, 31 и т.д.), а затем его подробное решение. Ответы записывайте чётко и разборчиво.
Для выполнения заданий 30, 31 используйте следующий перечень веществ: сульфит калия, гидроксид меди (II), хлор, хлороводород, оксид фосфора (III), гидроксид натрия. Допустимо использование водных растворов веществ.
- Из предложенного перечня выберите вещества, в результате окислительно-восстановительной реакции между которыми образуется две соли, содержащие в кислотных остатках атомы разных химических элементов, но имеющие одинаковый катион металла. В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.
31.Из предложенного перечня выберите два вещества, при протекании реакции ионного обмена между которыми образуется окрашенный раствор. Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.
- Через раствор силиката калия пропустили избыток углекислого газа. Выпавший осадок отделили и прокалили, а затем сплавили с фосфатом кальция и углём. Полученное простое вещество растворили на холоду в концентрированной азотной кислоте, причём выделился бесцветный газ. Напишите уравнения четырёх описанных реакций.
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
 При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.
При написании уравнений реакций указывайте преимущественно образующиеся продукты, используйте структурные формулы органических веществ.
- В 120 мл раствора с плотностью 0,591 г/мл (ВНИМАНИЕ: плотность вымышленная, так как не может быть плотность растворов солей меньше единицы), содержащего нитрат свинца (II) и нитрат меди (II) с массовыми долями 16,34 и 2,65% соответственно, насыпали 5,6 г железных опилок. Через некоторое время раствор отфильтровали. Масса твёрдых веществ составила 8,7 г. Определите соотношение числа ионов металлов в конечном растворе.
В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
- Неизвестное органическое вещество А содержит 34,62% углерода, а также водород и кислород, причём массовая доля кислорода в 15,982 раза больше массовой доли водорода. Известно, что 1 моль вещества А может вступить в реакцию с 2 моль гидроксида натрия, или 1 моль гидрокарбоната калия, или 1 моль метанола.
На основании данных условия задачи:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу вещества;
2) составьте структурную формулк вещества А, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции вещества А с избытком метанола (используйте структурные формулы органических веществ).
Ответы:
| 1. | 34 |
| 2. | 512 |
| 3. | 12 |
| 4. | 14 |
| 5. | 214 |
| 6. | 24 |
| 7. | 34 |
| 8. | 4124 |
| 9. | 2153 |
| 10. | 31 |
| 11. | 324 |
| 12. | 12 |
| 13. | 45 |
| 14. | 45 |
| 15. | 12 |
| 16. | 2315 |
| 17. | 2146 |
| 18. | 13 |
| 19. | 245 |
| 20. | 14 |
| 21. | 241 |
| 22. | 3226 |
| 23. | 1321 |
| 24. | 1212 |
| 25. | 1223 |
| 26. | 412 |
| 27. | 26 |
| 28. | 40 |
| 29. | 13,44 |
- P2O3 + 2Cl2 + 10NaOH = 2Na3PO4 + 4NaCl + 5H2O
2P+3 – 4e = 2P+5 1
Cl20 + 2e = 2Cl— 2
Хлор в степени окисления 0 (или Cl2) является окислителем.
Фосфор в степени окисления +3 (или P2O3) является восстановителем.
- Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2 + 2H+ + 2Cl— = Cu2+ + 2Cl— + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
- 1) K2SiO3 + 2CO2 + 2H2O = H2SiO3↓ + 2KHCO3
2) H2SiO3 = SiO2 + H2O
3) Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO
4) 3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
- N (Fe2+) : N (Pb2+) = 2 : 1. Видео-объяснение смотрите на Ютуб. (ВНИМАНИЕ: плотность 0,591 г/мл вымышленная, так как не может быть плотность растворов солей меньше единицы)
- 1. Общая формула вещества CxHyOz
ω (O + H) = 100% — 34,62% = 65,38%
Пусть ω (Н) = х %, тогда ω (О) = 15,982х %, следовательно получаем математическое уравнение:
х + 15,982х = 65,38
16,982х = 65,38
х = 3,85% (ω (Н)), ω (О) = 15,982∙3,67 = 61,53%
x : y : z = 34,62/12 : 3,85/1 : 61,53/16 = 2,885 : 3,85 : 3,85 = 3 : 4 : 4
Следовательно, молекулярная формула C3H4O4.
- По описанным данным, можно предположить, что раз это вещество реагирует только с 1 моль гидрокарбоната или 1 моль спирта, то значить в этом веществе находится одна карбоксильная группа, но так как это же вещество может реагировать с 2 моль щелочи, то значит есть эфирная связь, которая будет подвергаться щелочному гидролизу. Поэтому это монометиловый эфир щавелевой кислоты.
- Уравнение реакции:
А также вы можете получить доступ ко всем видео-урокам, заданиям реального ЕГЭ с подробными видео-объяснениями, задачам и всем материалам сайта кликнув:
- Посмотреть видео-объяснения решений всех типов задач вы можете здесь, нажав на эту строку
- Просмотреть задания ЕГЭ всех лет (реальные, пробные и тренировочные задания) вы можете здесь, нажав на эту строку
- Посмотреть все видео-уроки вы можете здесь, нажав на эту строку
- Прочитать всю теорию для подготовки к ЕГЭ и ЦТ вы можете здесь, нажав на эту строку

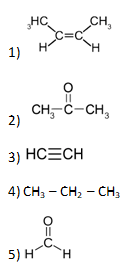

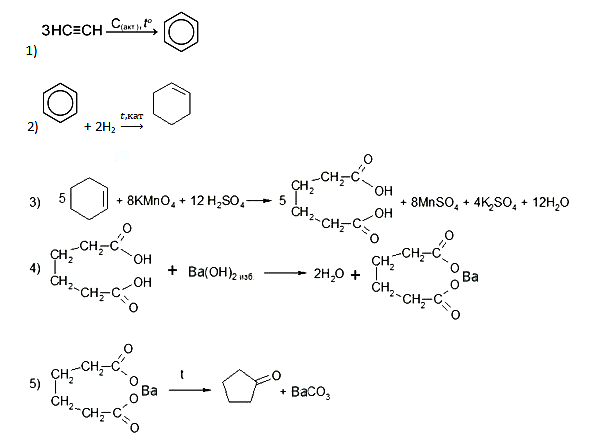


Здравствуйте. Вариант 1, задание 19 ответ 24, а не 245, реакция бензола с азотной кислотой не овр
Здравствуйте. Почему?
Потому что реакиця протекает без изменения степеней окисления.
Степень окисления углерода меняется, так как до реакции углерод был связан с вдородом, а после замещения связан с азотом, у которго выше электроотрицательность, поэтому степень окисления меняется
Согласен, это окислительно-восстановительная реакция.
А по какому принципу в 8 задание k2co3 реагирует с p2o5
Здравствуйте. По пронципу: твёрдый нелетучий кислотный оксид вытесняет летучий оксид из его соли при сплавлении (3K2CO3 + P2O5 = 2K3PO4 + 3CO2). Или в растворе реакция также будет, ведь P2O5 сначала прореагирует с водой и даст фосфорную кислоту, которая затем, как более сильная, вытеснит угольную кислоту из её соли. Но первое объяснение предпочтительнее.
здравствуйте,почему в 20 naoh является ответом ведь он меняет продукты реакции
Гидроксид натрияв этом случае НЕ меняет продукты реакции, так как в результате этой реакции и так образуется щёлочь (КОН), поэтому добавлении другой щёлочи ничего не изменит.
Вариант 1 задание 31. Написано: фосфор прореагировал с конц азотной кислотой, а ваш ответ: 3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
Но это же разбавленная!
Здравствуйте. В зависимости от типа аллотропной модификации фосфора и концентрации азотной кислоты могут образовываться РАЗНЫЕ продукты восстановления азотной кислоты, поэтому не обязательно должен получаться NO2. При взаимодействии белого фосфора с конц. азотной кислотой образуется, как правило, NO. Чтобы не сомневаться в этом, в условии задания написано, что образовался бесцветный газ, а не бурый газ NO2
У вас ошибка в 1 варианте.
Из предложенного перечня выберите два вещества, которые НЕ могут использоваться для получения пропаналя в одну стадию:
1) пропанол-1
2) пропеналь
3) 1,1-дихлорпропан
4) пропин
5) ацетат кальция
Ваш ответ: 45… А почему не 35?из пропина же можно получить пропаналь
Здравствуйте. Ошибки в ответах нет. Как из пропина в одну стадию вы получите пропаналь?
Если к 1,1-дихлорпропану добавить избыток водного раствора щёлочи, то в одну стадию получается пропаналь, поэтому ответ 3 — не правильный
Добрый день.Скажите,пожалуйста, почему в 32 задании получилось KHCO3, а не K2CO3.
Здравствуйте. Потому что при избытке углекислого газа образуется кислая соль, так как оксиду CO2 соответствует угольная кислота, в которой два атома водорода, а значит существует два типа солей: средняя и кислая. А когда в растворе избыток кислоты (раствор углекислого газа и является угольной кислотой), то и образуется кислая соль.
В учебниках химии, в справочниках по подготовке к ЕГЭ пишут, что азотная кислота (концентрированная) в реакция с неметаллами превращается в NO2. Как же это понимать?
Здравствуйте. С азотной кислотой не всё так просто. То что пишут в учебниках, то это общая закономерность. Но даже концентрированная кислота это очень обширное понятие, ведь массовая доля может сильно варьироваться. Поэтому если вам попадается задание, где вам нужно самостоятельно написать продукты, то следуйте правилам из учебников. А вот если вам попадается задача или задание 32 в ЕГЭ, где конкретно написано, какой продукт получается, то надо следовать условию задания, а не «общему» правилу.