Основные положения атомно-молекулярной теории
Первый определил химию как науку М. В. Ломоносов. Он считал, что химия должна строиться на точных количественных данных –“на мере и весе”. Ломоносов создал учение о строении вещества, заложил основу атомно-молекулярной теории.
Оно сводится к следующим положениям, изложенным в работе “Элементы математической химии”:
- Каждое вещество состоит из мельчайших, далее физически неделимых частиц (Ломоносов называл их корпускулами, впоследствии они были названы молекулами).
- Молекулы находятся в постоянном, самопроизвольном движении.
- Молекулы состоят из атомов (Ломоносов назвал их элементами).
- Атомы характеризуются определенным размером и массой.
- Молекулы могут состоять как из одинаковых, так и различных атомов.
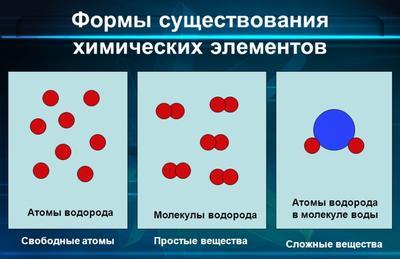
Молекула – это наименьшая частица вещества, сохраняющая его состав и химические свойства. Молекула не может дробиться дальше без изменения химических свойств вещества. Между молекулами вещества существует взаимное притяжение, различное у разных веществ. Молекулы в газах притягиваются друг к другу очень слабо, тогда как между молекулами жидких и твердых веществ силы притяжения относительно велики. Молекулы любого вещества находятся в непрерывном движении. Этим явлением объясняется, например, изменение объема веществ при нагревании.
Атомами называются мельчайшие, химически неделимые частицы, из которых состоят молекулы. Атом – это наименьшая частица элемента, сохраняющая его химические свойства. Атомы различаются зарядами ядер, массой и размерами.
При химических реакциях атомы не возникают и не исчезают, а образуют молекулы новых веществ. Элемент следует рассматривать как вид атомов с одинаковым зарядом ядра.
Химические свойства атомов одного и того же химического элемента одинаковы, такие атомы могут отличаться только массой. Разновидности атомов одного и того же элемента с различной массой, называются изотопами.
Поэтому, разновидностей атомов больше, чем химических элементов.
Необходимо различать понятия “химический элемент” и “простое вещество”.
Вещество – это определенная совокупность атомных и молекулярных частиц в любом из трех агрегатных состояний. Химический элемент – это общее понятие об атомах с одинаковым зарядом ядра и химическими свойствами. Физических свойств, характерных для простого вещества, химическому элементу приписать нельзя.
Простые вещества – это вещества, состоящие из атомов одного и того же химического элемента. Один и тот же элемент может образовывать несколько простых веществ.
Далее приведено современное изложение основных положений атомно-молекулярного учения:
- Все вещества состоят из атомов.
- Атомы каждого вида (элемента) одинаковы между собой, но отличаются от атомов любого другого вида (элемента).
- При взаимодействии атомов образуются молекулы: гомоядерные (при взаимодействии атомов одного элемента) или гетероядерные (при взаимодействии атомов разных элементов).
- При физических явлениях молекулы сохраняются, при химических – разрушаются; при химических реакциях атомы в отличие от молекул сохраняются.
- Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состоят первоначальные вещества.
Также вы можете посмотреть ВИДЕО-уроки на эту тему:
И выполнить задания из ЦТ и ЕГЭ на эту тему вы можете здесь




Добрый вечер ! Есть некоторые соображения по первоначальным химическим понятиям. Химический элемент — это символ,который не обладает никакими свойствами. Структурными единицами вещества современной химической наукой принято считать атомы,молекулы и ионы.Атомы химически делимы. Вещество следует рассматривать как один способов существования материи. Иначе, определение вещества через понятия атом или молекула, а определение последних посредством вещества создаёт замкнутый круг. Есть ещё одно заблуждение»при химических превращениях атомы сохраняются» не атомы, их ядра.
Продолжение. Молекулы могут диссоциировать и без изменения физических и химических свойств. Например, димер оксида азота (lv), молекула димер ртути, не говоря о химии полимеров и ассоциатах. Либо, оговорить в первом приближении.
P.S. нет в химии понятия вида ни у атомов, ни у молекул, тем более определенного. Возникает резонный вопрос , а что есть неопределенннный?
Здравствуйте. Спасибо вам за интересный комментарий. Во многом согласен с вами. Но на моём сайте, может к сожалению, мы не ищем истину, а просто готовим учеников к экзаменам по существующим стандартам и шаблонам. Я думаю, что вам будет более интересно подискутировать на форумах профессиональных химиков.