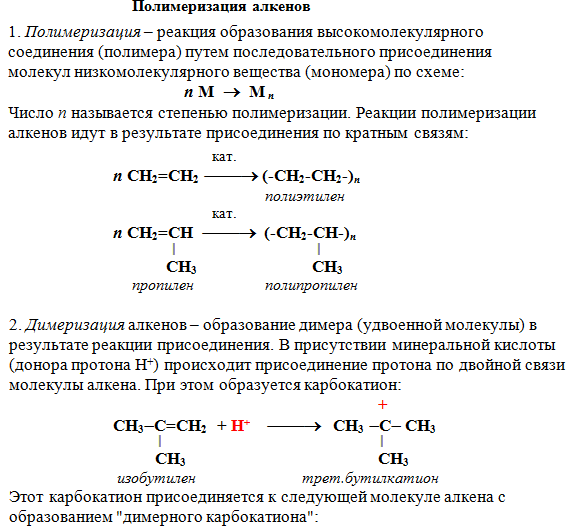
Свойства алкенов
Физические свойства алкенов закономерно изменяются в гомологическом ряду: от С2Н4 до С4Н8 – газы, начиная с С5Н10 –жидкости, с С18Н36 – твердые вещества. Алкены практически нерастворимы в воде, но хорошо растворяются в органических растворителях.
Химические свойства алкенов определяются строением и свойствами двойной связи С=С, которая значительно активнее других связей в молекулах этих соединений. Алкены химически более активны, чем алканы.
Характеристики углерод-углеродных связей:
Еs+p (энергия двойной связи) С=С (s+p) 620 кДж/моль
Еs (энергия s-связи) С-С 348 кДж/моль
Отсюда Еp (энергия p-связи) 272 кДж/моль,
т.е. Еp на 76 кДж/моль меньше Еs.
Поэтому для алкенов наиболее характерны реакции, протекающие за счет раскрытия менее прочной p-связи. При этом p-связь (в исходном алкене) преобразуется в s-связь в продукте реакции. Исходное ненасыщенное соединение превращается в насыщенное без образования других продуктов, т.е. происходит реакция присоединения.
По какому механизму идут реакции присоединения к алкенам?
- За счет электронов p-связи в молекулах алкенов имеется область повышенной электронной плотности (облако p-электронов над и под плоскостью молекулы. Поэтому двойная связь склонна подвергаться атаке электрофильным (электронодефицитным) реагентом. В этом случае будет происходить гетеролический разрыв связей и реакция пойдет по ионному механизму как электрофильное присоединение (АЕ).
- С другой стороны, углерод-углеродная p-связь, являясь неполярной, может разрываться гомолитически, и тогда реакция будет идти по радикальному механизму (АR).
Механизм присоединения зависит от условий проведения реакции.
Кроме того, алкенам свойственны реакции изомеризации и окисления (в том числе реакция горения, характерная для всех углеводородов).
 Реакция идет по механизму электрофильного присоединения с гетеролитическим разрывом связей.
Реакция идет по механизму электрофильного присоединения с гетеролитическим разрывом связей.
Электрофилом является протон Н+ в составе молекулы галогеноводорода. Направление реакции присоединения галогеноводородов к алкенам несимметричного строения (например, к пропилену CH2=CH—СН3) определяется правилом Марковникова:
В реакциях присоединения полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи (т.е атому углерода, связанному с наибольшим числом атомов водорода).
Так, в реакции HCl c пропиленом из двух возможных структурных изомеров 1-хлорпропана и 2-хлорпропана, образуется последний:
CH2=CH—СН3 + HCl = СН3—CHCl —CH3
пропилен 2-хлорпропан
Эта закономерность была первоначально установлена эмпирически. В современной органической химии дано теоретическое обоснование правила Марковникова на основе положения о влиянии электронного строения молекул на их реакционную способность.
Следует отметить, что правило Марковникова в его классической формулировке соблюдается только для электрофильных реакций самих алкенов. В случае некоторых производных алкенов или при изменении механизма реакции возможно несоблюдение этого правила.
Присоединение против правила Марковникова отмечается в случаях, когда заместитель при двойной связи оттягивает электронную плотность на себя, т.е. проявляет электроноакцепторные свойства (–I и/или –М-эффект).
Например, в реакции трихлорпропена Сl3C-CH=CH2 с HХ водород присоединяется к менее гидрогенизированному атому углерода, а Х – к более гидрогенизированному. Это обусловлено тем, группа СCl3 проявляет отрицательный индуктивный эффект и p-электронная плотность связи С=С смещена к менее гидрогенизированному атому углерода
Кроме того, если реакция присоединения идет не по электрофильному, а по радикальному механизму, то правило Марковникова также не соблюдается. Так, реакция HBr с пропиленом в присутствии пероксидов (H2O2 или R2O2), образующих свободно-радикальные частицы (НО· или RО·), происходит по радикальному механизму и идет против правила Марковникова.
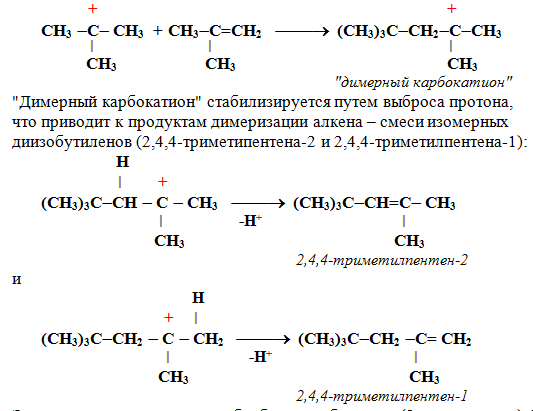 Этот процесс протекает при обработке изобутилена (2-метипропена) 60% серной кислотой при температуре 70°С. Образовавшаяся в результате смесь диизобутиленов подвергается гидрированию с целью получения «изооктана» (2,2,4-триметилпентана), который применяется для улучшения антидетонационной способности бензина («изооктан – стандарт моторного топлива с октановым числом 100).
Этот процесс протекает при обработке изобутилена (2-метипропена) 60% серной кислотой при температуре 70°С. Образовавшаяся в результате смесь диизобутиленов подвергается гидрированию с целью получения «изооктана» (2,2,4-триметилпентана), который применяется для улучшения антидетонационной способности бензина («изооктан – стандарт моторного топлива с октановым числом 100).
Подобно реакции димеризации алкенов происходит их полимеризация, только процесс не останавливается на стадии образования димера, а идет дальше и включает в себя множество стадий присоединения молекул алкена к растущему карбокатиону.