Физические свойства алканов
Первые четыре представителя гомологического ряда метана — газы. Простейший из них — метан — газ без цвета, вкуса и запаха (запах «газа», определяется запахом меркаптанов — серосодержащих соединений, специально добавляемых к метану, используемому в бытовых и промышленных газовых приборах для того, чтобы люди, находящиеся рядом с ними, могли по запаху определить утечку).
Углеводороды состава от С5Н12 до С15Н32 — жидкости; более тяжелые углеводороды — твердые вещества. Температуры кипения и плавления алканов постепенно увеличиваются с возрастанием длины углеродной цепи. Все углеводороды плохо растворяются в воде, жидкие углеводороды являются распространенными органическими растворителями.
Химические свойства алканов
Реакции замещения.
Наиболее характерными для алканов являются реакции свободнорадикального замещения, в ходе которого атом водорода замещается на атом галогена или какую-либо группу. Приведем уравнения характерных реакций галогенирования (которые протекают при освещении или нагревании):

В случае избытка галогена хлорирование может пойти дальше, вплоть до полного замещения всех атомов водорода на хлор:

Полученные вещества широко используются как растворители и исходные вещества в органических синтезах.

Реакция дегидрирования (отщепления водорода).
В ходе пропускания алканов над катализатором (Pt, Ni, А1203, Сг203) при высокой температуре (400-600 °С) происходит отщепление молекулы водорода и образование алкена:
![]()
Реакции, сопровождающиеся разрушением углеродной цепи.
Все предельные углеводороды горят с образованием углекислого газа и воды. Газообразные углеводороды, смешанные с воздухом в определенных соотношениях, могут взрываться.
1. Горение предельных углеводородов — это свободнорадикальная экзотермическая реакция, которая имеет очень большое значение при использовании алканов в качестве топлива:
![]() В общем виде реакцию горения алканов можно записать следующим образом:
В общем виде реакцию горения алканов можно записать следующим образом:
![]() 2. Термическое расщепление углеводородов.
2. Термическое расщепление углеводородов.
![]() Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов.
Процесс протекает по свободнорадикальному механизму. Повышение температуры приводит к гомолитическому разрыву углерод-углеродной связи и образованию свободных радикалов.
![]() Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:
Эти радикалы взаимодействуют между собой, обмениваясь атомом водорода, с образованием молекулы алкана и молекулы алкена:
![]() Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
Реакции термического расщепления лежат в основе промышленного процесса — крекинга углеводородов. Этот процесс является важнейшей стадией переработки нефти.
3. Пиролиз. При нагревании метана до температуры 1000 °С начинается пиролиз метана — разложение на простые вещества:
![]() При нагревании до температуры 1500 °С возможно образование ацетилена:
При нагревании до температуры 1500 °С возможно образование ацетилена:
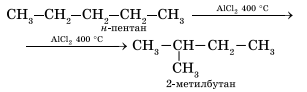
![]() 4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
4. Изомеризация. При нагревании линейных углеводородов с катализатором изомеризации (хлоридом алюминия) происходит образование веществ с разветвленным углеродным скелетом:
 5. Ароматизация. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:
5. Ароматизация. Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола и его производных:
 Алканы вступают в реакции, протекающие по свободнорадикальному механизму, т. к. все атомы углерода в молекулах алканов находятся в состоянии sp3-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных С—С (углерод — углерод) связей и слабополярных С—Н (углерод — водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т. е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т. к. связи в молекулах алканов не разрываются по гетеролитическому механизму.
Алканы вступают в реакции, протекающие по свободнорадикальному механизму, т. к. все атомы углерода в молекулах алканов находятся в состоянии sp3-гибридизации. Молекулы этих веществ построены при помощи ковалентных неполярных С—С (углерод — углерод) связей и слабополярных С—Н (углерод — водород) связей. В них нет участков с повышенной и с пониженной электронной плотностью, легко поляризуемых связей, т. е. таких связей, электронная плотность в которых может смещаться под действием внешних факторов (электростатических полей ионов). Следовательно, алканы не будут реагировать с заряженными частицами, т. к. связи в молекулах алканов не разрываются по гетеролитическому механизму.

